Legame covalente non polare
- 1552
- 228
- Lino Lombardi
Spieghiamo cos'è un legame covalente non polare, le sue caratteristiche e diversi esempi
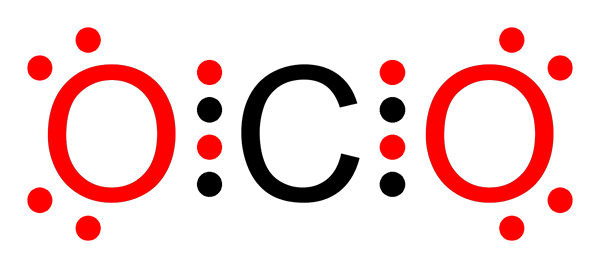
 Legame covalente non polare di anidride carbonica
Legame covalente non polare di anidride carbonica Cos'è un legame covalente non polare?
UN legame covalente non polare, Chiamato anche legame covalente puro o apolare, è l'unione di due atomi che condividono una o più coppie di elettroni equamente. In altre parole.
Questo tipo di collegamento è tra due atomi uguali (dello stesso elemento) o tra due atomi diversi, ma che hanno elettronegatività molto simili.
Esistono tre tipi di collegamenti chimici che tengono insieme gli atomi. Questi sono: il legame ionico, il legame covalente e il collegamento metallico. Questi collegamenti differiscono in base al modo in cui gli elettroni sono distribuiti attorno agli atomi.
Nel caso di legami covalenti, i due atomi condividono gli elettroni di valenza, il che significa che questi elettroni, invece di ruotare attorno a un atomo, ruotano attorno ai due. Tuttavia, questo non è sempre equo, poiché gli elettroni preferiscono trascorrere più tempo vicino all'atomo più elettronegativo, dando origine a un legame covalente polare.
Nel caso di legami covalenti non polari ciò non accade, poiché entrambi gli atomi hanno la stessa elettronegatività o elettronegatività molto simili.
Caratteristiche del collegamento covalente non polare
1. Si formano tra atomi con elettronegatività uguali o molto simili
Sono collegamenti covalenti che si formano tra atomi uguali o che hanno elettronegatività molto simili. In generale, un legame covalente non è considerato polare se la differenza di elettronegatività è inferiore o uguale a 0,4.
Può servirti: acido succinico: struttura, proprietà, ottenimento, usi2. Possono essere semplici, doppi o tripli
A seconda del numero di coppie di elettroni che entrambi gli atomi condividono, i legami covalenti non polari o apolari possono essere semplici, doppi o tripli.
Quando il legame è formato da una singola coppia di elettroni, viene chiamato un semplice collegamento, quando sono condivise due coppie di elettroni, è chiamato doppio legame e se sono condivise tre coppie di elettroni, si chiama triple link.
3. Coinvolgono quasi sempre i non metal
I metalli sono elementi con elettronegatività molto basse che formano collegamenti metallici tra loro. Se collegati a non metalli, formano sempre legami ionici o collegamenti polari. Per questo motivo, i legami covalenti non polari si formano solo tra elementi non metallici come idrogeno e carbonio.
4. Danno origine a composti apolari
Un composto che ha solo legami covalenti non polari sarà formato da molecole apolari. Questi tipi di composti sono caratterizzati da bassi punti di ebollizione e fusione rispetto ai metalli e ai composti ionici (alcuni sono persino gas a temperatura ambiente), sono insolubili in acqua e sono cattivi conduttori di calore ed elettricità.
5. Possono formare composti solidi, liquidi o gassosi a temperatura ambiente
I composti con legami covalenti non polari possono avere punti di ebollizione e fusione bassi ma molto vari.
Per questo motivo, alcuni di essi sono gas a temperatura ambiente (come l'idrogeno, H2, e azoto, n2), altri sono liquidi (come Bromo, BR2), mentre altri sono solidi (come naftalene, c10H8).
6. Hanno energie di collegamento relativamente basse.
Rispetto ai collegamenti ionici, i legami covalenti non polari sono più facili da rompere, poiché hanno un'energia di collegamento inferiore. Ciò significa che devi usare meno energia per rompere un legame covalente non polare rispetto a un legame ionico.
Può servirti: leggi stechiometricheEsempi di collegamenti covalenti non polari
Collegamento H-H nella molecola di idrogeno (H2)
Nella molecola di idrogeno, h2, Due atomi di idrogeno condividono i loro unici elettroni di valenza per formare un semplice legame covalente.
 Molecola di idrogeno
Molecola di idrogeno Poiché entrambi gli atomi sono uguali, la differenza di elettronegatività tra i due sarà zero, quindi questo collegamento è un legame covalente non polare.
Collegamento F-F nella molecola di fluoro (F2)
Questo esempio sottolinea il fatto che non importa l'elettronegatività di un atomo, ma la differenza nelle elettronegatività dei due atomi che formano un collegamento per sapere se il collegamento sarà covalente non polare o no.
 Molecola di fluoro
Molecola di fluoro Il fluoro è l'elemento più elettronegativo della tabella periodica, quindi tende a rimuovere i suoi elettroni dagli altri elementi per formare legami polari o ionici.
Tuttavia, quando un atomo di fluoro è collegato ad un altro pari a lui, né può rimuovere gli elettroni dall'altro (non c'è differenza nell'elettronegatività), quindi non hanno altra scelta che condividerli equamente e forma, quindi, quindi, a, a collegamento covalente non polare.
Collegamenti o-o nella molecola di ozono (o3)
Come nel caso della molecola di fluoro, l'ossigeno è anche un elemento molto elettronegativo. Tuttavia, formando collegamenti con altri atomi di ossigeno, forma legami covalenti non polari. Questo è il caso della molecola di ozono.
 Molecola di ozono
Molecola di ozono In questo caso, l'atomo di ossigeno centrale è collegato ad altri due atomi di ossigeno mediante legami covalenti non polari o apolari.
Può servirti: ossido di magnesio: struttura, proprietà, nomenclatura, usiCollegamento N-N nella molecola di azoto (n2)
La molecola di azoto contiene un legame covalente non polare, in cui ogni atomo di azoto condivide i suoi tre elettroni di valenza sono scomparsi con l'altro.
 Molecola di azoto
Molecola di azoto Per questo motivo, entrambi gli atomi condividono un totale di tre coppie di elettroni, formando così un triplo legame covalente.
Collegamenti C-H nella molecola di metano (CH4)
Il metano è un esempio di un legame covalente non polare formato tra atomi di diversi elementi, in questo caso, carbonio e idrogeno.
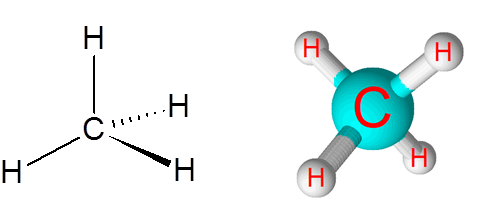 Molecola di metano
Molecola di metano La differenza di elettronegatività tra i due elementi è 0,4 che pone questo bordo solo tra i legami non polari e polari.
Collegamento c = c nella molecola di etilene (c2H4)
La molecola di etilene, chiamata anche Eteno, ha un totale di cinque collegamenti. Quattro collegamenti C-H e un doppio legame C = C. In entrambi i casi, i collegamenti corrispondono a legami covalenti non polari o apolari.
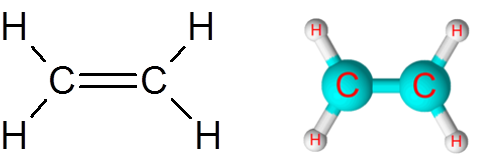 Molecola di etilene
Molecola di etilene
- « 6 balli e balli tipici di Quintana Roo più famoso
- Le 9 danze e le danze tipiche di Michoacán sono più famose »

