Bond covalente doppio

- 4662
- 1374
- Cosetta Messina
Spieghiamo cos'è un doppio legame covalente, le sue caratteristiche e diamo diversi esempi
 Molecola di eteno o etilene. È un tipico esempio di un doppio legame covalente tra due atomi di carbonio
Molecola di eteno o etilene. È un tipico esempio di un doppio legame covalente tra due atomi di carbonio Cos'è un legame doppio covalente?
IL legami doppi covalenti Sono collegamenti chimici in cui due atomi condividono due coppie di elettroni. In altre parole, sono legami covalenti formati da un totale di quattro elettroni di valenza che ruotano intorno a due atomi.
I doppi collegamenti sono molto comuni nei composti organici. Ad esempio, tutti gli alcheni hanno un legame a doppia carbonio carbonio. Molti altri gruppi funzionali come aldeidi, chetoni, acidi carbossilici e ammidi hanno anche legami doppi covalenti tra carbonio e ossigeno. Altri, come l'Imine, hanno legami doppi covalenti c = n.
I doppi collegamenti hanno molte caratteristiche che li distinguono da altri tipi di legami covalenti come collegamenti semplici e tripli collegamenti. Differiscono nella forma delle molecole che le contengono, nella forza di lunghezza e di collegamento e altre caratteristiche relative alle loro proprietà chimiche.
Caratteristiche di collegamento a doppio covalente
Sono formati da 4 elettroni
Il motivo per cui i doppi legami sono perché contengono doppi elettroni di un semplice legame covalente, che si forma quando due atomi condividono due elettroni di valenza. Ciò significa che ogni doppio legame contiene 4 elettroni.
Sono formati da un collegamento Sigma Link (σ) e un PI (π)
Dei 4 elettroni che formano un doppio legame, 2 di loro stanno andando tra un atomo e un altro, passando attraverso il centro dei due. Questa coppia di elettroni sono chiamati elettroni Sigma, poiché formano un legame Sigma (σ).
L'altra coppia di elettroni galleggia sopra e sotto i due atomi che fanno una specie di sandwich. Questi elettroni sono chiamati elettroni PI e formano un collegamento PI (π).
Può servirti: clorobenzene (C6H5Cl)Insieme, il collegamento Sigma e il collegamento PI formano il doppio legame covalente.
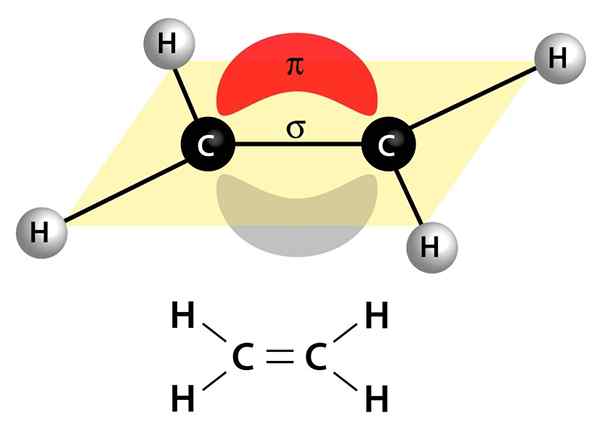 Questa immagine mostra i due collegamenti che compongono un doppio legame: il collegamento PI che appare come una nuvola rossa e grigia che è sopra e sotto la molecola e il collegamento Sigma che è la linea che si unisce a entrambi i nuclei attraverso il centro
Questa immagine mostra i due collegamenti che compongono un doppio legame: il collegamento PI che appare come una nuvola rossa e grigia che è sopra e sotto la molecola e il collegamento Sigma che è la linea che si unisce a entrambi i nuclei attraverso il centro Possono essere polari o apolari
A seconda dell'elettronegatività degli atomi che sono uniti per mezzo di un doppio legame covalente, può essere polare o apolare.
Ad esempio, un doppio legame covalente C = c Sarà un collegamento apolare, poiché entrambi gli atomi sono uguali e hanno la stessa elettronegatività. Invece, un doppio legame covalente C = O Sarà polare, poiché l'ossigeno è molto più elettronegativo del carbonio.
Sono più forti dei collegamenti semplici
Rompere un doppio legame è più difficile che rompere un semplice legame tra gli stessi due atomi. Questo perché, per rompere un doppio legame, sia un collegamento Sigma (che è uguale al collegamento semplice) e un collegamento PI deve essere rotto. Poiché due collegamenti devono essere rotti anziché uno, il doppio legame è più forte del semplice.
Sono più deboli dei tripli collegamenti
Rispetto al triplo collegamento, il doppio legame è più debole e più facile da rompere. Il motivo è lo stesso di prima, solo che, in questo caso, il doppio legame ha meno collegamenti rispetto alla rottura rispetto al triplo collegamento.
Sono più brevi dei collegamenti semplici
Essendo collegamenti più forti rispetto ai collegamenti semplici, i doppi legami sono in grado di avvicinare gli atomi collegati rispetto ai collegamenti semplici rispetto ai semplici collegamenti. Per questo motivo, se un collegamento doppio C = C viene confrontato con un semplice collegamento C-C, il primo è sempre più corto del secondo.
Può servirti: tiosolfato di sodio (Na2S2O3)Sono più lunghi dei tripli collegamenti
Ancora una volta, quando il triplo collegamento è più forte del doppio collegamento, il triplo collegamento è più breve. Ciò implica che i legami doppi covalenti sono più lunghi della tripla.
Sono collegamenti rigidi.
I legami covalenti semplici sono abbastanza flessibili e possono anche ruotare. D'altra parte, i doppi legami sono rigidi, non sono flessibili e non possono essere ruotati, poiché il collegamento PI che è stato menzionato sopra sarebbe rotto.
Rappresentano insaturazione
Una molecola che ha un doppio legame avrà due atomi di idrogeno meno collegati di quanto potrebbe avere. Per questo motivo, si dice che un doppio legame rappresenti una insaturazione (ogni insaturazione corrisponde a 2 idrogeni).
Formano molecole a forma di triangolo piatto
Un atomo di carbonio che forma un doppio legame covalente e altri due semplici legami, forma sempre una molecola piatta in cui i tre legami indicano le estremità di un triangolo. Questa forma si chiama geometria trigonale piatta.
Esempi di legami doppi covalenti
Link c = c in etilene
L'etilene è uno degli esempi più semplici di un legame doppio covalente, in questo caso tra due atomi di carbonio.
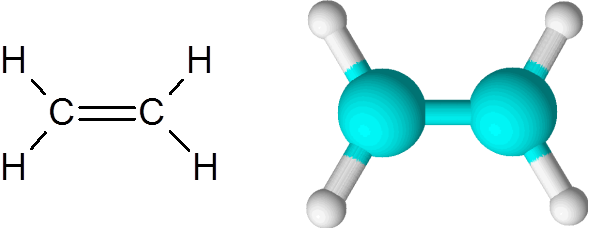 Molecola di etilene
Molecola di etilene La molecola è completamente piatta e non è possibile ruotare il collegamento in qualsiasi direzione. Questo doppio legame è totalmente apolare, poiché sta collegando due atomi uguali.
Link c = o in acetone
Tutti i chetoni contengono un gruppo carbonilico, che consiste in un atomo di carbonio e un atomo di ossigeno uniti per mezzo di un legame a doppio covalente.
Può servirti: cos'è la cinetica chimica?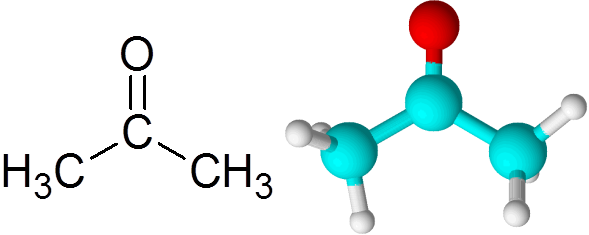 Molecola di acetone
Molecola di acetone Ogni atomo contribuisce con due elettroni mancanti a formare sia il collegamento PI che Sigma che compongono il doppio legame. La maggior parte delle reazioni chimiche che si verificano ai chetoni sono dovute al doppio legame C = O.
Il collegamento o = o nella molecola di ozono (o3)
In questo caso, l'atomo di ossigeno centrale è collegato ad altri due atomi di ossigeno. Uno dei due legami è formato da 4 elettroni, quindi corrisponde a un doppio legame covalente. I tre atomi e un paio di elettroni senza condividere che hanno l'atomo di ossigeno centrale sono tutti nello stesso piano dello schermo che puntano agli angoli di un triangolo.
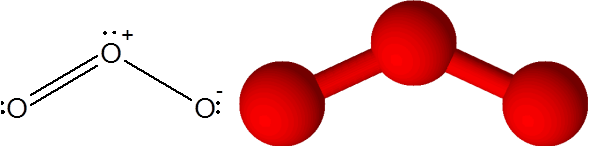 Molecola di ozono
Molecola di ozono L'ozono ha la peculiarità che il doppio legame può "saltare" da uno degli ossigeno terminale all'altro. In effetti, lo fa molto rapidamente attraverso un processo chiamato risonanza.
C = c collegamenti nel butadieno (c4H6)
Butadieno è un esempio di un composto organico che ha due doppi legami covalenti c = c.
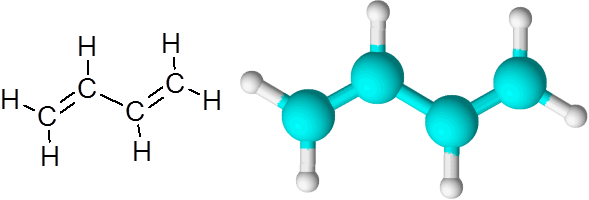 Molecola 1.3-butadiene
Molecola 1.3-butadiene Quando i doppi legami sono in questo modo, separati da un singolo semplice link, si dice che siano doppi collegamenti coniugati.

