Unità di energia libera di Helmholtz, come vengono calcolati e risolti esercizi

- 3795
- 679
- Dante Morelli
IL Energia libera di Helmholtz È un potenziale termodinamico che misura l'utile lavoro di un sistema chiuso a temperatura costante e condizioni di volume. L'energia libera di Helmholtz è indicata come F Ed è definito come la differenza dall'energia interna O Meno il prodotto di temperatura T Per entropia S:
F = u - t⋅s
Poiché è energia, viene misurato in Joules nel sistema internazionale (SI), sebbene altre unità appropriate possano essere anche ERGIOS (CG), calorie o volt di elettroni (EV).
 Figura 1. Definizione dell'energia di Helmholtz. Fonte: Pixabay.
Figura 1. Definizione dell'energia di Helmholtz. Fonte: Pixabay. La variazione negativa dell'energia di Helmholtz durante un processo è equiparata al massimo lavoro che il sistema può eseguire in un processo isocorico, ovvero al volume costante. Quando il volume non è costante, parte di questo lavoro può essere svolto sull'ambiente.
In questo caso ci riferiamo al lavoro in cui il volume non varia, come il lavoro elettrico: DW = φdq, con φ come potenziale elettrico e Q come carica elettrica.
Se la temperatura è anche costante, l'energia di Helmholtz viene ridotta al minimo quando viene raggiunto l'equilibrio. Per tutto ciò, l'energia di Helmholtz è particolarmente utile nei processi di volume costanti. In questo caso hai:
- Per un processo spontaneo: ΔF < 0
- Quando il sistema è in equilibrio: ΔF = 0
- In un processo non spontaneo: ΔF> 0.
[TOC]
Come viene calcolata l'energia libera di Helmholtz?
Come affermato all'inizio, l'energia di Helmholtz è definita come "l'energia o il sistema interno, ad eccezione del prodotto della temperatura assoluta del sistema, dall'entropia S del sistema":
F = u - t⋅s
È una funzione della temperatura T e del volume V. I passaggi per visualizzare questo sono i seguenti:
Può servirti: elettroni interni- A partire dalla prima legge della termodinamica, l'energia interna o è correlata all'entropia S del sistema e al suo volume V per i processi reversibili attraverso la seguente relazione differenziale:
DU = DQ - DW = TDS - PDV
Ciò ne consegue che l'energia interna o è una funzione delle variabili S E V, Perciò:
U = u (s, v)
- Ora la definizione di F Ed è derivato:
df = du - d (ts) = du - tds - sdt
- Sostituire lì l'espressione differenziale ottenuta per DU nel primo passo, rimane:
Df = tds - pdv - tds - sdt = -sdt - pdv
- Infine, si è concluso che F è una funzione della temperatura T e del volume V e può essere espressa come:
F = f (t, v)
 figura 2. Hermann von Helmholtz (1821-1894), fisico e medico tedesco, ha riconosciuto per i suoi contributi all'elettromagnetismo e alla termodinamica, tra le altre aree della scienza. Fonte: Wikimedia Commons.
figura 2. Hermann von Helmholtz (1821-1894), fisico e medico tedesco, ha riconosciuto per i suoi contributi all'elettromagnetismo e alla termodinamica, tra le altre aree della scienza. Fonte: Wikimedia Commons. Processi spontanei
L'energia di Helmholtz può essere applicata come criterio generale di spontaneità nei sistemi isolati, ma prima che alcuni concetti debbano essere specificati:
- UN Sistema chiuso Può scambiare energia con l'ambiente, ma non può scambiare materia.
- Invece a sistema isolato non scambia materia o energia con l'ambiente.
- Finalmente a sistema aperto Scambia materia ed energia con l'ambiente.
 Figura 3. Sistemi termodinamici. Fonte: Wikimedia Commons. Fjgar (bis) [CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0)].
Figura 3. Sistemi termodinamici. Fonte: Wikimedia Commons. Fjgar (bis) [CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0)]. Nei processi reversibili la variazione dell'energia interna viene calcolata come segue:
DU = TDS - PDV
Supponiamo ora un processo di volume costante (isocorico), in cui il secondo termine dell'espressione precedente ha un contributo nullo. Bisogna anche ricordare che secondo il Disuguaglianza di Clausius:
ds ≥ dq/t
Tale disuguaglianza si applica a un sistema termodinamico isolato.
In modo che per un processo (reversibile o meno) in cui il volume viene mantenuto costante è soddisfatto:
Può servirti: acido fosforico (H3PO4)T ds ≥ du (A volume fisso)
Tenendo conto di ciò:
df = du - t ds
Dovremo in un processo isocorico a temperatura costante Df ≤ 0, Come indicato all'inizio.
In modo che l'energia di Helmholtz F sia una quantità decrescente in un processo spontaneo mentre è un sistema isolato. F raggiunge il suo valore minimo e stabile quando è stato raggiunto un saldo reversibile.
Esercizi risolti
Esercizio 1
Calcola la variazione dell'energia libera di Helmholtz F per 2 moli di gas ideale a una temperatura di 300k durante un'espansione isotermica che porta al sistema di un volume iniziale di 20 litri a un volume finale di 40 litri.
Soluzione
A partire dalla definizione di f:
F = u - t s
Quindi una variazione finita di F, chiamata ΔF, sarà:
ΔF = ΔU - T ΔS
Poiché la dichiarazione afferma che la temperatura è costante: ΔT = 0. Tuttavia, nei gas ideali, l'energia interna dipende solo dalla sua temperatura assoluta, ma poiché si tratta di un processo isotermico, quindi ΔU = 0 E Δf = - t ΔS. Per i gas ideali, la variazione entropica di un processo isotermico è scritta in questo modo:
ΔS = n.R.ln (v2/V1)
Applicare questa espressione:
ΔS = 2 moli x 8.314 j/(k mol) x ln (40l/20l) = 11,53 j/k
Infine, il cambiamento nell'energia di Helmholtz è:
ΔF = - T ΔS = - 300K x 11,53 j/k = -3457,70 j.
Esercizio 2
All'interno di un cilindro c'è un pistone che lo divide in due sezioni e su ciascun lato del pistone ci sono N moli di un gas monoatomico ideale, come mostrato nella figura seguente.
Le pareti del cilindro sono buoni conduttori di calore (diatermici) e sono in contatto con un serbatoio di temperatura TO.
Il volume iniziale di ciascuna delle sezioni del cilindro è V1i e v2i, mentre i suoi volumi finali sono v1f e v2f Dopo uno spostamento quasiestatico. Il pistone si muove per mezzo di uno stantuffo che attraversa ermeticamente le due tapas cilindri.
Può servirti: Tecnecio (TC): Struttura, Proprietà, Usi, OttenimentoViene chiesto di trovare:
a) il cambiamento nell'energia interna del gas e il lavoro svolto dal sistema e
b) Variazione energetica di Helmholtz.
Soluzione a
Mentre il pistone si muove in modo quasi, la forza esterna applicata allo stantuffo deve bilanciare la forza a causa della differenza di pressione nelle due sezioni del cilindro.
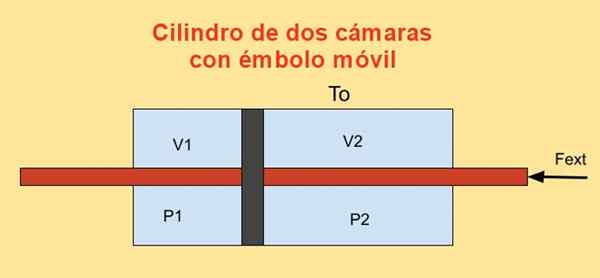 Figura 4. Variazione dell'energia libera F in un cilindro con due telecamere. Fonte: f. Zapata.
Figura 4. Variazione dell'energia libera F in un cilindro con due telecamere. Fonte: f. Zapata. Il lavoro Dw Realizzato dalla forza esterna Fext Durante uno spostamento infinitesimale Dx È:
Dw = - fext Dx = (p1 - P2) A dx = p1 Dv1 + P2 Dv2
Dove è stata usata la relazione Dv1 = - dv2 = A DX, essendo A L'area del pistone. D'altra parte, la variazione dell'energia di Helmholtz è:
Df = -sdt - pdv
Poiché durante il processo la temperatura non cambia, quindi dt = 0 E Df = - pdv. Applicare questa espressione a ciascuna sezione del cilindro che hai:
dw = p1 Dv1 + P2 Dv2 = - df1 - Df2
Essendo F1 E F2 Le energie di Helmholtz in ciascuna delle telecamere.
Il lavoro a W finito può essere calcolato dalla variazione finita dell'energia di Helmholtz di ciascuna fotocamera:
W = -Δf1 - ΔF2
Soluzione b
Per trovare il cambio di energia da Helmholtz, viene utilizzata la definizione: F = u - t s. Come in ogni fotocamera hai un gas monoatomico ideale a temperatura costante TO, L'energia interna non cambia (ΔU = 0), in modo che: Δf = - tO ΔS. Oltretutto:
ΔS = nr ln (VF/Sega)
Che sostituendolo finalmente consente il lavoro svolto è:
W = -tO Nr ln (V1f /V1i) -To nr ln (V2f /V2i) = -Δf1 -ΔF2
W = - a nr ln [(v1f ⋅ v1i)/(V2f .V2i)] = - ΔFtotale
Essendo ΔFtotale La variazione totale dell'energia di Helmholtz.
Riferimenti
- Castaños e. Esercizi di energia libera. Recuperato da: Lidiaconlachimica.WordPress.com
- Librettexts. Energia Helmholtz. Recuperato da: Chem.Librettexts.org
- Librettexts. Cosa sono l'energia libera. Recuperato da: Chem.Librettexts.org
- Wikipedia. Energia Helmholtz. Recuperato da: è.Wikipedia.com
- Wikipedia. Energia libera di Helmholtz. Recuperato da: in.Wikipedia.com

