Gibbs unità energetiche libere, come vengono calcolati e risolti esercizi
- 1640
- 432
- Silvano Montanari
IL Gibbs Energia libera (comunemente chiamato g) è un potenziale termodinamico definito come la differenza nell'entalpia H, tranne il prodotto della temperatura t, dall'entropia s del sistema:
G = h - t s
Gibbs Free Energy viene misurata a Joules (secondo il sistema internazionale), in Ergios (per il sistema di unità), in calorie o volt di elettroni (Per elettro volt).
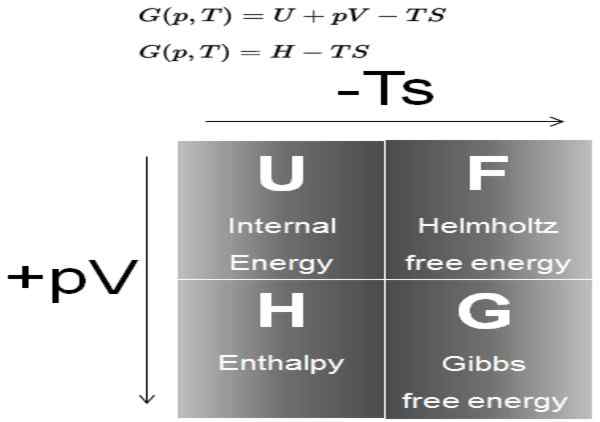
 Figura 1. Diagramma che mostra la definizione di energia di Gibbs e la sua relazione con gli altri potenziali termodinamici. Fonte: potenza nucleare.netto.
Figura 1. Diagramma che mostra la definizione di energia di Gibbs e la sua relazione con gli altri potenziali termodinamici. Fonte: potenza nucleare.netto. Nei processi che si verificano a pressione e temperatura costanti, la variazione dell'energia libera di Gibbs è ΔG = ΔH - T ΔS. In tali processi, (g) rappresenta l'energia disponibile nel sistema che può diventare lavoro.
Ad esempio, nelle reazioni chimiche esotermiche, l'entalpia diminuisce mentre l'entropia aumenta. Nella funzione Gibbs questi due fattori sono contrastati, ma solo quando l'energia di Gibbs diminuisce la reazione si verifica spontaneamente.
Quindi, se la variazione di G è negativa, il processo è spontaneo. Quando la funzione Gibbs raggiunge il minimo, il sistema raggiunge un equilibrio stabile. In breve, in un processo per il quale la pressione e la temperatura rimangono costanti possiamo affermare:
- Se il processo è spontaneo, allora ΔG < 0
- Quando il sistema è in equilibrio: ΔG = 0
- In un processo non spontaneo, aumenta: ΔG> 0.
[TOC]
Come viene calcolato?
Gibbs Free Energy (G) è calcolato dalla definizione fornita all'inizio:
G = h - t⋅s
A sua volta, Entalpy H è un potenziale termodinamico definito come:
H = u + p v
- Passo dopo passo
Successivamente, verrà eseguita un'analisi del passo di passo, per conoscere le variabili indipendenti di cui l'energia di Gibbs è una funzione:
1- Della prima legge della termodinamica, l'energia interna è correlata all'entropia S del sistema e al suo volume V per i processi reversibili attraverso la relazione differenziale:
Può servirti: bromuro di etidio: struttura, proprietà, usi, tossicitàDU = DQ - DW = TDS - PDV
Da questa equazione segue che l'energia interna u è una funzione delle variabili s e v:
U = u (s, v)
2- A partire dalla definizione di H e si ottiene il differenziale:
dh = du + d (p v) = du + vdp + pdv
3- Sostituzione dell'espressione per Du ottenuta in (1) devi:
DH = TDS - PDV + VDP + PDV = TDS + VDP
Da qui si è concluso che l'entalpia H dipende dall'entropia e dalla pressione P, cioè:
H = H (s, p)
4- Ora viene calcolato il differenziale di energia libera di Gibbs totale:
Dg = dh -tds -sdt = tds + vdp -tds -sdt
Dove DH è stato sostituito dall'espressione trovata in (3).
5- Infine, semplificando di ottenere: Dg = vdp - sdt, È chiaro che l'energia libera G dipende dalla pressione e dalla temperatura T come:
G = g (p, t)
- Le relazioni termodinamiche di Maxwell
Dall'analisi nella sezione precedente segue che l'energia interna di un sistema è una funzione di entropia e volume:
U = u (s, v)
Quindi il differenziale di O Essere:
Du = ∂SU |V Ds + ∂VU |S DV = TDS - PDV
Da questa espressione in derivati parziali, le relazioni termodinamiche di Maxwell così riccate possono essere dedotte. I derivati parziali si applicano quando una funzione dipende da più di una variabile e vengono facilmente calcolate applicando il teorema della sezione seguente.
La prima relazione di Maxwell
∂VT |S = -MonSP |V
Per arrivare a questa relazione, il Teorema di Clairaut - Schwarz su derivati parziali, che indica i seguenti:
"I derivati misti del secondo ordine con le variabili scambiate sono uguali, a condizione che le funzioni da derivare siano continue e differenziabili".
La seconda relazione di Maxwell
A partire da ciò che è stato dimostrato nel punto 3 della sezione precedente:
Può servirti: fattori che influenzano la solubilitàH = H (S, P) e DH = TDS + VDP
Può essere ottenuto:
∂PT |S = ∂SV |P
Procedi in modo simile con Gibbs Free Energy G = g (p, t) e con l'energia libera di Helmholtz F = f (t, v) Per ottenere le altre due relazioni termodinamiche di Maxwell.
 figura 2. Josiah Gibbs (1839-1903) era un fisico, chimico e matematico americano che ha dato un grande contributo alla termodinamica. Fonte: Wikimedia Commons.
figura 2. Josiah Gibbs (1839-1903) era un fisico, chimico e matematico americano che ha dato un grande contributo alla termodinamica. Fonte: Wikimedia Commons. Le quattro relazioni termodinamiche di Maxwell
1- Associato all'energia interna u: ∂VT |S = -MonSP |V
2- quello ottenuto da Entalpy H: ∂PT |S = ∂SV |P
3- correlato all'energia di Helmholtz f: ∂TP |V = ∂VS |T
4- collegato all'energia libera di Gibbs G: ∂TV |P = -MonPS |T
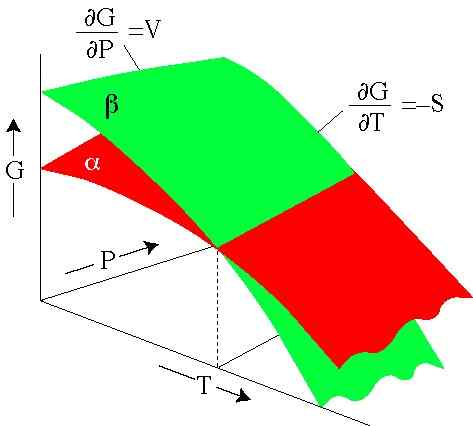 figura 2. L'energia di Gibbs dipende dalla pressione e dalla temperatura. Ogni superficie rappresenta una fase. (SERC.Carleton.Edu)
figura 2. L'energia di Gibbs dipende dalla pressione e dalla temperatura. Ogni superficie rappresenta una fase. (SERC.Carleton.Edu) Esercizi risolti
Esercizio 1
Calcola la variazione dell'energia libera di Gibbs per 2 moli di gas ideale a una temperatura di 300k durante un'espansione isotermica che porta al sistema di volume iniziale di 20 litri a un volume finale di 40 litri.
Soluzione
Ricordare la definizione di Gibbs Free Energy è:
G = h - t s
Quindi una variazione finita di F sarà:
ΔG = ΔH - T ΔS, poiché Δt = 0
Nell'entalpia di gas ideale dipende solo dalla sua temperatura assoluta, ma in quanto è un processo isotermico, allora ΔH = 0 e ΔG = - T ΔS.
Per i gas ideali la variazione di entropia di un processo isotermico è:
ΔS = nr ln (V2/V1)
Che si applica al caso di questo esercizio che abbiamo:
ΔS = 2 moli x 8.314 j/(k mol) x ln (40l/20l) = 11,53 j/k
Quindi possiamo ottenere il cambiamento nell'energia di Helmholtz:
ΔG = - 300K x 11,53 J/K = -3457,70 J.
Esercizio 2
Tenendo conto che l'energia libera di Gibbs è una funzione di temperatura e pressione G = G (T, P); Determina la variazione di G durante un processo in cui la temperatura non cambia (isotermica) per n moli di un gas monoatomico ideale.
Può servirti: idrossido di stronzio (SR (OH) ₂)Soluzione
Come dimostrato sopra, la variazione dell'energia di Gibbs dipende solo dalla variazione della temperatura T e del volume V, quindi una variazione infinitesimale di essa viene calcolata secondo:
Dg = -sdt + vdp
Ma se si tratta di un processo in cui la temperatura è costante quindi df = + vdp, quindi una variazione finita della pressione ΔP porta a un cambiamento nell'energia di Gibbs data da:
ΔG = + ∫ VDP = + ∫ (n r t) dp/p = + n r t ln (ΔP)
Usando l'equazione del gas ideale:
P v = n r t
Durante un processo isotermico accade che:
D (p v) = p dv + v dp = 0
Questo è:
dp/p = - dv/v
Quindi il risultato precedente può essere scritto in base alla variazione del volume ΔV:
ΔG = + ∫ VDP = + ∫ (n r t) dp/p = - ∫ (n r t) dv/v = -n r t ln (Δv)
Esercizio 3
Considerando la seguente reazione chimica:
N20 (g) + (3/2) o2 (g) ↔️No2 (g) a temperatura t = 298 K
Trova la variazione dell'energia libera di Gibbs e attraverso il risultato ottenuto, indica se si tratta o meno di un processo spontaneo.
Soluzione
Sotto i passaggi:
- Primo passo: entalpie di reazione
ΔHr = 2*ΔH (no2 (g)) - ΔH (n20 (g)) = 2*33.2-81.6 = -15.2kj/mol
- Secondo passo: la variazione dell'entropia di reazione
ΔSr = 2*s (no2 (g)) - s (n20 (g)) - (3/2) s (o2 (g)) = 2*240.1 - 220.1 - 1.5*205.2 = -47.7 J/(mol*K).
- Terzo passaggio: variazione nella funzione Gibbs
Questo valore determinerà l'equilibrio tra energia decrescente e aumento dell'entropia per sapere se la reazione è finalmente spontanea o meno.
ΔGR = ΔHR -T ΔSR = -15.2 -298*(-47,7) = -985,4 J/mol
Poiché è una variazione negativa dell'energia di Gibbs, si può concludere che si tratta di una reazione spontanea alla temperatura di 298 K = 25 ºC.
Riferimenti
- Castaños e. Esercizi di energia libera. Recuperato da: Lidiaconlachimica.WordPress.com.
- Cengel, e. 2012. Termodinamica. 7a edizione. McGraw Hill.
- Librettexts. Gibbs Energia libera. Recuperato da: Chem.Librettexts.org
- Librettexts. Cosa sono l'energia libera. Recuperato da: Chem.Librettexts.org
- Wikipedia. Gibbs Energia libera. Recuperato da: è.Wikipedia.com
- Wikipedia. Gibbs Energia libera. Recuperato da: in.Wikipedia.com
- « Metodo MOHR Fondamenti, reazioni, procedura, usi
- Concetto e caratterizzazione dei sistemi cristallini, tipi, esempi »

