Energia interna

- 1095
- 229
- Lino Lombardi
Spieghiamo cos'è l'energia interna, la sua funzione, come calcolarla e dare diversi esempi
 Diagramma che mostra contributi all'energia interna di un sistema. Fonte: f. Zapata
Diagramma che mostra contributi all'energia interna di un sistema. Fonte: f. Zapata Cos'è l'energia interna?
IL Energia interna Da un oggetto deriva dal movimento casuale che gli atomi e le molecole che lo compongono. Anche quando l'oggetto è perfettamente a riposo, all'interno, a livello microscopico, le particelle che lo compongono si muovono continuamente senza riposo.
Poiché queste particelle si stanno muovendo, hanno energia cinetica, che fa parte della loro energia interna. L'altro contributo all'energia interna è l'energia potenziale che deriva dalle forze intermolecolari, responsabile del mantenimento della coesione della sostanza.
Queste forze intermolecolari sono generalmente di origine elettromagnetica, ma partecipano anche le forze gravitazionali e nucleari.
Ora, a seconda del tipo di movimento delle particelle, l'energia cinetica può essere:
- Traslazionale
- Vibrazionale
- Rotazionale
La temperatura misura solo l'energia cinetica traslazionale delle particelle. In linea di principio, a una temperatura maggiore, l'energia interna sarà maggiore, ma questo dipende anche dalla massa. UN esempio Il problema chiarisce: un bicchiere con acqua calda ha meno energia interna di un lago a temperatura ambiente, sebbene la temperatura del vetro sia più elevata e questo perché c'è più acqua nel lago che nel vetro.
In ogni caso, l'energia interna di una sostanza non è evidente in vista, non dipende dal suo movimento, né dipende dalla sua posizione relativa rispetto ad altri oggetti. Ad esempio, l'energia interna di un vetro con acqua a temperatura ambiente è la stessa se il vetro è su un tavolo o se si trova sul pavimento.
Può servirti: vettori non -coplanar: definizione, condizioni, eserciziFunzione energetica interna
L'energia interna, che di solito è indicata come U, è una funzione che dipende dalle variabili termodinamiche del sistema, come la temperatura T e il volume V. Pertanto, può essere espresso matematicamente come:
U = u (t, v)
In realtà, il valore assoluto dell'energia interna di un sistema non è rilevante, ciò che conta è la sua variazione, che è indicata con la lettera greca Δ ("delta"):
ΔU = u iniziale - O finale
Ora, l'energia interna può essere variata se il calore viene aggiunto o estratto. Aggiunta di calore è possibile che il sistema faccia un certo lavoro, come un pistone nel cilindro di un motore.
La prima legge della termodinamica
Dalla prima legge della termodinamica è stabilito La variazione dell'energia interna Da un sistema equivalente a:
ΔU = Q - W
Dove è la quantità di calore che viene trasferita al sistema e W è il lavoro svolto dal sistema, nel caso in cui esegui alcuni. Tutto è misurato a Joules nel sistema internazionale di unità.
Se il sistema non funziona, il calore fornito viene utilizzato nella sua interezza per aumentare l'energia interna del sistema.
Quanto segue segue l'espressione precedente:
- ΔU> 0 significa che il sistema aumenta la sua energia interna
- ΔU < 0 la energía interna del sistema disminuye
- Q> 0 Il sistema assorbe il calore
- W> 0 Il sistema funziona.
Come calcolare l'energia interna?
Il gas ideale monoatomico
Nel modello di gas ideale monoatomico (un singolo atomo), le particelle non interagiscono tra loro, quindi l'energia cinetica traslazionale è l'unico contributo all'energia interna o al gas. C'è un teorema, chiamato Teorema dell'equipaggiamento, che afferma che ogni grado di libertà ha un'energia pari a:
Può servirti: diffrazione delle onde: concetto ed esempiDove t è la temperatura e r è la costante dei gas ideali, il cui valore nelle unità del sistema internazionale è:
8.314472 J/mol ∙ K
Un grado di libertà rappresenta la possibilità di muoversi in una certa direzione nello spazio. Una particella di gas ideale può muoversi nelle tre direzioni dello spazio, quindi l'energia di N moli di gas è:
Quantità di calore
Supponendo che il calore venga aggiunto a un sistema e questo non funziona, questo calore viene utilizzato solo per aumentare l'energia interna del sistema. La quantità di calore che deve essere proporzionale alla massa m del sistema e al cambiamento di temperatura:
Q ∝ m⋅Δt
La costante di proporzionalità dipende dalla sostanza ed è chiamata calore specifico. Chiamando C a questa costante, il calore è:
Q = Mc⋅δt
Poiché il calore viene invertito nell'aumentare l'energia interna:
Q = mc⋅Δt = ΔU
ΔU corrisponde a la variazione In energia interna.
Esempi di energia interna
1. Variazioni di temperatura
Le variazioni della temperatura delle sostanze a loro volta generano cambiamenti nella loro energia interna. Questo è ciò che accade, ad esempio, durante la cottura. Riscaldando gli alimenti, l'agitazione delle sue molecole aumenta, l'energia cinetica aumenta e quindi fa la sua energia interna.
2. Energia interna di due sostanze alla stessa temperatura
Due sostanze alla stessa temperatura non hanno necessariamente la stessa energia interna, poiché dipende da due contributi: energia cinetica e energia potenziale.
Se le sostanze sono alla stessa temperatura, si può affermare che l'energia cinetica traslazionale delle sue particelle è la stessa, ma l'energia potenziale è diversa, poiché ciò dipende dalla configurazione degli atomi costituenti.
Può servirti: pressione idrostatica: formula, calcolo, esempi, esercizi3. Dilatazione termica
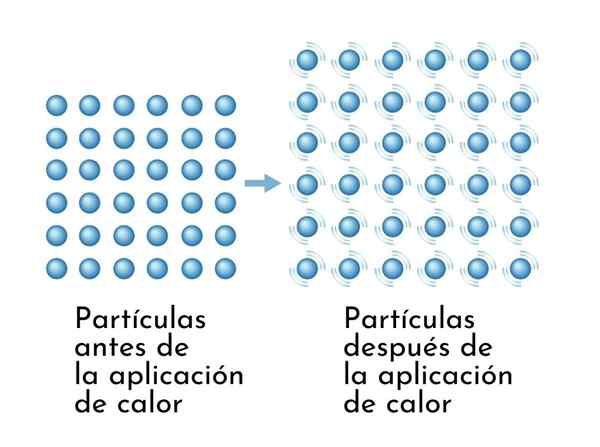 Le sostanze si espandono quando riscaldate, poiché l'aumento dell'energia interna fa vibrare le loro particelle più ampiamente, quindi le dimensioni aumentano
Le sostanze si espandono quando riscaldate, poiché l'aumento dell'energia interna fa vibrare le loro particelle più ampiamente, quindi le dimensioni aumentano Una conseguenza visibile delle sostanze di riscaldamento è l'aumento delle loro dimensioni, poiché aumenta la distanza media tra i suoi atomi.
Le forze intermolecolari possono essere simulate attraverso le molle che uniscono Atom.
4. Gas compressi
I gas compressi possono archiviare energia interna, poiché la loro densità aumenta diminuendo il volume e con esso le sue interazioni con le pareti del contenitore contenitore. In questo modo un gas compresso è in grado di fare un lavoro come spostare un pistone.
5. Batterie
In una batteria si verificano reazioni chimiche in grado di generare una corrente elettrica non appena il circuito si chiude. Questa energia potenziale chimica è considerata parte dell'energia interna del sistema.
6. Sistema che assorbe il calore e funziona
Quando un sistema assorbe il calore, aumenta la sua energia interna. Ma se allo stesso tempo fa un lavoro, la prima legge della termodinamica può essere usata per sapere quanta energia cambia interno. Ad esempio, supponendo che un sistema assorbe 175 J di calore e svolga un lavoro equivalente a 62 J, il cambiamento nella sua energia interna è:
ΔU = Q - W = 175 J - 62 J = 113 J.



