Energia di attivazione

- 3420
- 634
- Kayla Serr
Spieghiamo qual è l'energia di attivazione, la sua formula, le unità, come viene calcolata e diamo diversi esempi
Cos'è l'energia di attivazione?
IL energia di attivazione (EA) È definito come l'energia minima necessaria per la reazione chimica. In altre parole, è la barriera energetica che deve essere superata in modo che i reagenti possano diventare prodotti.
L'energia di attivazione può essere vista in azione nella vita quotidiana. In effetti, sappiamo tutti che, quando si apre la chiave di passaggio del gas in cucina, non brucia immediatamente quando viene a contatto con l'aria.
In modo che inizi la reazione a combustione, è necessario fornire una scintilla o il fuoco di una partita. Questa scintilla o questo incendio rappresenta l'energia di attivazione della reazione di combustione.
Perché è richiesta un'energia di attivazione?
Per capire il motivo per cui le reazioni necessitano di un'energia minima, è importante capire, in primo luogo, come si verificano. Per reagire due atomi o molecole, devono prima scontrarsi. Inoltre, devono farlo con il giusto orientamento in modo che possano essere formati nuovi legami chimici e i vecchi possono rompere.
Tuttavia, anche se le due molecole sono dirette tra loro con l'orientamento perfetto, ciò non assicura che venga somministrata una collisione efficace, a causa della repulsione tra gli elettroni della superficie delle molecole.
Per questo motivo, è necessario che, oltre a un orientamento corretto, le molecole viaggono anche con una certa velocità o con un po 'di energia cinetica minima che garantisce che la collisione sia abbastanza forte da contrastare la repulsione degli elettroni.
Questa energia cinetica minima necessaria a livello microscopico è quella che si traduce nell'energia di attivazione della reazione.
Può servirti: bromuro di litio: struttura, proprietà, usi, rischiCiò che viene visto in un diagramma di energia?
Un diagramma di energia è una rappresentazione grafica che mostra come l'energia dei reagenti varia man mano che si trasformano in prodotti. In questi diagrammi, come quello presentato di seguito, è facile vedere e interpretare l'energia di attivazione.

In questo grafico la linea blu mostra l'energia man mano che la reazione avanza. Qui puoi vedere che, per diventare i prodotti, i reagenti devono prima superare una collina per raggiungere lo stato di transizione. Altrimenti, verranno restituiti al loro stato iniziale.
L'altezza di questa collina è esattamente l'energia di attivazione. Se è possibile superare, il resto della strada è in discesa e i reagenti finiscono rapidamente diventando i prodotti.
Unità energetiche di attivazione
L'energia di attivazione è una grandezza intensiva espressa in unità energetiche su massa o moli. Poiché ci sono diverse unità energetiche e diverse unità di massa, l'energia di attivazione può essere espressa in diverse unità diverse. Tuttavia, quelli utilizzati più frequentemente in chimica sono:
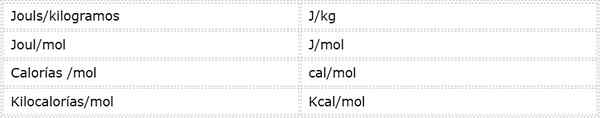
Quale unità viene utilizzata dipende dai dati da cui vengono calcolati o dall'uso che verrà fornito in altri calcoli.
Formula di energia di attivazione
L'energia di attivazione è correlata alla velocità di reazione. In effetti, maggiore è l'energia di attivazione, minore è la velocità. Questa relazione è espressa matematicamente attraverso l'equazione di Arrhenius, che mette in relazione la costante di velocità di una reazione alla temperatura.
Può servirti: reagente Benedict: a cosa serve, componenti, preparazione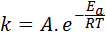
In questa equazione, K È la costante di velocità della reazione eA È l'energia di attivazione, r è la costante dei gas ideali, t è la temperatura assoluta e si chiama fattore pre-esponenziale di Arrhenius, chiamato anche fattore di collisione.
Questa equazione può essere riorganizzata per dare:
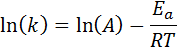
Se è noto il valore di A per la reazione, allora l'energia di attivazione può essere ottenuta cancellando l'equazione precedente. Tuttavia, questo non è il modo in cui viene generalmente determinata l'energia di attivazione di una reazione. Normalmente la costante di velocità è determinata a due o più temperature, il che rende inutile sapere.
Come viene calcolata l'energia di attivazione?
L'energia di attivazione è determinata dai valori della costante di velocità a temperature diverse. Almeno due valori di K misurato a diversi valori t per calcolare l'energia di attivazione senza saperlo, che di solito è il caso.
A seconda di quanti valori di K Hanno, puoi calcolare eA In due modi:
1. Quando hai K a due temperature
In questi casi, è più facile iniziare dalla prima forma dell'equazione di Arrhenius. Se chiamiamo K1 alla costante di velocità a temperatura T1 E K2 alla costante di velocità a temperatura T2, Quindi possiamo scrivere due volte l'equazione di Arrhenius:
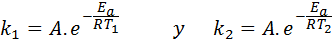
Ora, possiamo dividere una delle due equazioni tra l'altra per annullare A:
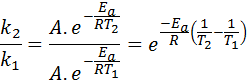
Quindi, prendendo il logaritmo neperiano su entrambi i lati e risolve per EA, è ottenuto:
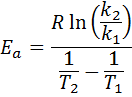
2. Quando hai K più di due temperature
Nei casi in cui vi sono diverse determinazioni della costante di velocità a varie temperature, è preferibile trovare l'energia di attivazione graficamente o mediante regressione lineare. Questo si basa sull'equazione in forma logaritmica, che ha la forma di una linea:
Può servirti: Clausius-Clapeyron Equation: a cosa serve, esempi, esercizi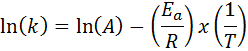
Se realizziamo un grafico di LN (k) contro (1/t), otterremo una linea retta che taglia all'asse E in ln (a) e la cui pendenza è uguale a -(eA/R). Da lì si ottiene l'energia di attivazione.
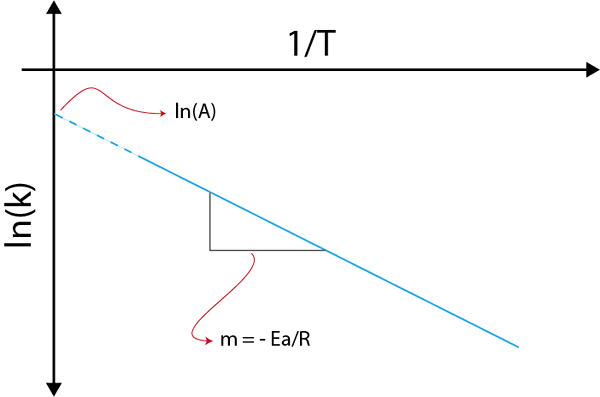 Grafico arrhenius per determinare l'energia di attivazione
Grafico arrhenius per determinare l'energia di attivazione Esempi di calcolo delle energie di attivazione
Esempio 1
La costante di velocità di una reazione del primo ordine è stata determinata a due diverse temperature. 298 K aveva un valore di 0.058 s-1, mentre a 350 K il valore è aumentato a 0,425 s-1. Determina l'energia di attivazione di questa reazione in J/mol.
- Soluzione: Poiché hai la costante a due temperature, la formula di energia di attivazione mostrata sopra può essere utilizzata direttamente. Poiché l'energia è richiesta nelle unità J/mol, dobbiamo usare la costante di gas in queste unità:
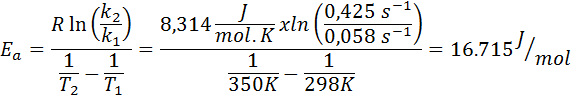
Esempio 2
Costante di velocità per una reazione chimica di secondo ordine viene misurata a temperature diverse. I valori sono presentati nella tabella seguente. Determina l'energia di attivazione in kcal/mol.
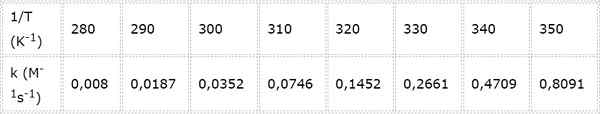
- Soluzione: Come in questo caso ci sono diverse temperature, è preferibile determinare graficamente l'energia di attivazione. Per fare questo, viene realizzato un grafico di Ln (k) vs 1/T, che è presentato di seguito.
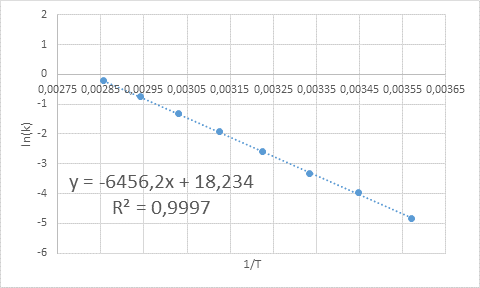 Esempio di determinazione grafica dell'energia di attivazione
Esempio di determinazione grafica dell'energia di attivazione Dall'equazione della linea mostrata nel grafico si ottiene la pendenza, che è -6456.2. Poiché la pendenza (m) è uguale a - eA/R, quindi:
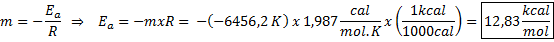
Cioè, l'energia di attivazione di questa reazione è di 12,83 kcal/mol.

