Elettronegatività
- 2217
- 74
- Dott. Rodolfo Gatti
Cos'è l'elettronegatività?
IL Elettronegatività È una proprietà periodica relativa che riguarda la capacità di un atomo di attirare la densità elettronica del suo ambiente molecolare. Questa è la tendenza di un atomo per attirare elettroni in sé quando è attaccato a una molecola. Ciò si riflette nel comportamento di molti composti e su come interagiscono intermolecolarmente tra loro.
In altre parole, più elettronegativo è un atomo, maggiore è la capacità di attirare elettroni di altri atomi; Avrà anche un potenziale di ionizzazione più elevato, che ti consente di mantenere i tuoi elettroni di fronte all'attrazione esterna attirando elettroni degli atomi circostanti.
Ora, non tutti gli elementi attirano elettroni di atomi adiacenti allo stesso grado. Nel caso di coloro che producono densità elettronica, si dice che lo siano elettropositivo, Mentre quelli che "coprono" gli elettroni sono elettronegativi. Esistono molti modi per spiegare e osservare questa proprietà (o concetto).
Ad esempio, nelle mappe dei potenziali elettrostatici per una molecola (come la biossido di cloro dell'immagine superiore, CLO, CLO2) Si osserva l'effetto delle diverse elettronegatività per gli atomi di cloro e ossigeno.
Il colore rosso indica le regioni ricche di elettroni della molecola, Δ- e il colore blu che sono poveri di elettroni, Δ+. Pertanto, dopo una serie di calcoli computazionali questo tipo di mappe può essere stabilito; Molti di loro mostrano una relazione diretta tra la posizione degli atomi elettronegativi e Δ-.
Può anche essere visualizzato come segue: all'interno di una molecola è più probabile che il transito degli elettroni si verifichi in prossimità degli atomi più elettronegativi.
È per questo motivo che per il CLO2 Gli atomi di ossigeno (sfere rosse) sono circondati da una nuvola rossa, mentre l'atomo di cloro (la sfera verde) di una nuvola bluastra.
La definizione di elettronegatività dipende dall'approccio dato al fenomeno, ci sono diverse scale che lo considerano da vari aspetti. Tuttavia, tutte le scale hanno in comune che sono supportate dalla natura intrinseca degli atomi.
Scale di elettronegatività
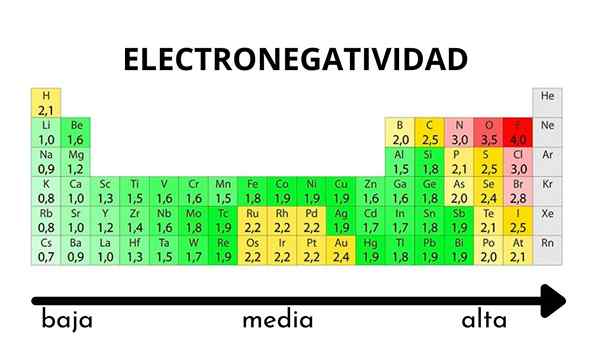
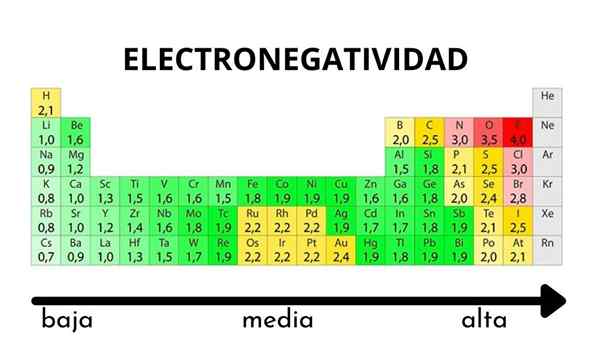 Nella tabella periodica può essere osservato quando il valore dell'elettronegatività aumenta o diminuisce
Nella tabella periodica può essere osservato quando il valore dell'elettronegatività aumenta o diminuisce L'elettronegatività non è una proprietà che può essere quantificata né ha valori assoluti. Questo perché la tendenza di un atomo di attirare la densità elettronica verso di lui non è la stessa in tutti i composti. In altre parole: l'elettronegatività varia a seconda della molecola.
Se per la molecola CLO2 L'atomo di CL sarà cambiato in N, quindi anche la tendenza di o di attrarre gli elettroni verrebbe modificata; Potrebbe essere aumentato (ottenere la nuvola di rosso) o diminuire (perdere colore). La differenza si troverebbe nel nuovo collegamento N-O formato, per avere la molecola O-N-O (biossido di azoto, no2).
Può servirti: relazione tra chimica e tecnologia con essere umano, salute e ambientePoiché l'elettronegatività di un atomo non è la stessa per tutti i suoi ambienti molecolari, è necessario definirlo in base ad altre variabili. In questo modo, ci sono valori che servono da riferimento e che consentono di prevedere, ad esempio, il tipo di collegamento che si forma (ionico o covalente).
Pauling Scale
Il grande scienziato e vincitore di Two Nobel Awards, Linus Pauling (1901-1994), cresciuto nel 1932 una forma quantitativa (misurabile) di elettronegatività, nota come Pauling Scale. In esso, l'elettronegatività di due elementi, A e B, che formavano collegamenti, era correlata all'energia extra associata al carattere ionico del collegamento A-B.
Teoricamente i legami covalenti sono i più stabili, poiché la distribuzione dei loro elettroni tra due atomi è equa; Cioè, per le molecole A-A e B-B, entrambi gli atomi condividono gli elettroni di legame allo stesso modo. Tuttavia, se a è più elettronegativo, allora la coppia sarà più che di B.
In tal caso, A-B non è più completamente covalente, sebbene se le sue elettronegatività non differiscono molto, si può dire che il suo collegamento ha un carattere covalente elevato. Quando ciò si verifica, il collegamento subisce una piccola instabilità e acquisisce energia extra come prodotto della differenza di elettronegatività tra A e B.
Maggiore è questa differenza, più l'energia del collegamento A-B e, di conseguenza, maggiore è il carattere ionico di detto collegamento.
Questa scala rappresenta la più utilizzata in chimica e i valori di elettronegatività sono emersi dall'allocazione di un valore di 4 per l'atomo di fluoro (l'elemento con l'elettronegatività più bassa è Cessium, con 0,7). Da lì potevano calcolare quello degli altri elementi.
Scala Mulliken
Mentre la scala Pauling ha a che fare con l'energia associata ai collegamenti, la scala Robert Mulliken (1896-1986) è più correlata ad altre due proprietà periodiche: energia di ionizzazione (EI) e affinità elettronica (AE).
Pertanto, un elemento con alti valori di EI e AE è molto elettronegativo e quindi attirerà elettroni dal suo ambiente molecolare.
Perché? Perché riflette quanto sia difficile "avviare" un elettrone esterno e quanto stabile l'anione si è formato in una fase gassosa è così stabile. Se entrambe le proprietà hanno elevate magnitudini, allora l'elemento è "amante" degli elettroni.
Può servirti: fusioneLe elettronegatività di Mulliken sono calcolate con la seguente formula:
ΧM = ½ (ei + ae)
Cioè, χM È uguale al valore medio di EI e AE.
Tuttavia, a differenza della scala Pauling che dipende da quali atomi formano i collegamenti, ciò è correlato alle proprietà dello stato di Valencia (con le sue configurazioni elettroniche più stabili).
Entrambe le scale generano valori di elettronegatività simili per gli elementi e si riferiscono approssimativamente alla seguente conversione:
ΧP = 1.35 (χM)1/2 - 1.37
Entrambi xM come xP Sono valori senza dimensioni; cioè, mancano di unità.
Scala di a.L. Allred ed e. Rochow
Ci sono altre scale di elettronegatività, come Sanderson e Allen. Tuttavia, quello che segue i primi due è la scala Allred e Rochow (χAr). Questa scala si basa sull'efficace carico nucleare che un elettrone sperimenta sulla superficie degli atomi. Pertanto, è direttamente correlato alla forza attraente del nucleo e all'effetto schermo.
Come varia l'elettronegatività nella tabella periodica?
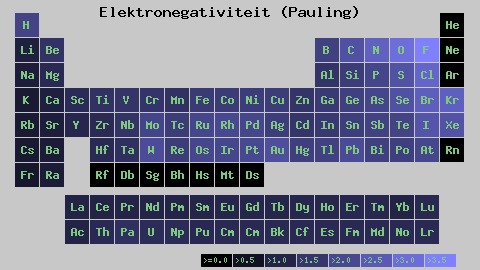 Pauling Electronegatity Scale. Fonte: Wikimedia Commons
Pauling Electronegatity Scale. Fonte: Wikimedia Commons Indipendentemente dalle scale o dai valori che ha, l'elettronegatività aumenta da destra a sinistra per un periodo e dal basso verso l'alto nei gruppi. Pertanto, aumenta verso la diagonale in alto a destra (non contando l'elio) fino a quando il fluoro è.
Nell'immagine superiore, ha detto appena. Nella tabella periodica, le elettronegatività Pauling sono espresse in base ai colori delle scatole. Poiché il fluoro è il più elettronegativo, dipende da un colore viola più ruvido, mentre i colori meno elettronegativi (o elettropositivi).
Si può anche vedere che le teste di gruppo (H, BE, B, C, ecc.) Hanno i colori più chiari e quando il gruppo è discendente dagli altri elementi. Cosa riguarda? La risposta è di nuovo nelle proprietà EI, AE, Zef (carico nucleare effettivo) e sul raggio atomico.
L'atomo nella molecola
I singoli atomi hanno una Z nucleare reale e gli elettroni esterni subiscono un efficace prodotto di carico nucleare dell'effetto di schermatura.
Mentre si muove per un periodo, Zef aumenta in modo tale che l'atomo sia contratto; cioè, le radio atomiche sono ridotte durante un periodo.
Ciò si traduce in questo, al momento del collegamento di un atomo con un altro, gli elettroni "scorreranno" sull'atomo con Zef maggiore. Inoltre, questo dà un carattere ionico al collegamento se c'è una marcata tendenza degli elettroni per andare a un atomo. Quando no, si parla di un legame prevalentemente covalente.
Può servirti: vetro violaPer questo motivo, l'elettronegatività varia in base alle radio atomiche, Zef, che a loro volta sono strettamente correlate a EI e AE. Tutto è una catena.
Elettronegatività
L'elettronegatività serve, in linea di principio, a determinare se un composto binario è covalente o ionico. Quando la differenza di elettronegatività è molto alta (alla velocità di 1.7 unità o più) si dice che il composto sia ionico.
È anche utile discernere in una struttura che le regioni saranno probabilmente più ricche negli elettroni.
Da qui si può prevedere quale meccanismo o reazione può subire il composto. In povere regioni di elettroni, Δ+, è possibile che le specie caricate negativamente ottenute in un certo modo; E nelle regioni ricche di elettroni, i loro atomi possono interagire in modi molto specifici con altre molecole (interazioni dipolo-dipolo).
Esempi (cloro, ossigeno, sodio, fluoro)
Quali sono i valori di elettronegatività per cloro, ossigeno, sodio e atomi di fluoro? Dopo il fluoro, che è il più elettronegativo? Usando la tavola periodica si osserva che il sodio ha un colore viola scuro, mentre i colori dell'ossigeno e il cloro sono visivamente molto simili.
I loro valori di elettronegatività per le scale di Pauling, Mulliken e Allred-Rhow sono:
Na (0.93, 1.21, 1.01).
O (3.44, 3.22, 3.cinquanta).
Cl (3.16, 3.54, 2.83).
F (3.98, 4.43, 4.10).
Si noti che con i valori numerici c'è una differenza tra le negatività dell'ossigeno e del cloro.
Secondo la scala Mulliken, il cloro è più elettronegativo dell'ossigeno, a differenza delle scale Pauling e Allred-Rhochow. La differenza di elettronegatività tra i due elementi è ancora più evidente usando la scala Allred-Rhow. E infine, il fluoro, indipendentemente dalla scala scelta, è il più elettronegativo.
Pertanto, dove c'è un atomo di F in una molecola significa che il collegamento avrà un carattere ionico elevato.
Riferimenti
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione., P. 30 e 44). Mc Graw Hill.
- Jim Clark. (2000). Elettronegività. Preso da: ChemGuide.co.UK
- Anne Marie Helmestine, PH.D. (11 dicembre 2017). Definizione ed esempio di elettronegatizzazione. Tratto da: Thoughtco.com
- Mark E. Tuckerman. (5 novembre 2011). Scala dell'elettronegatity. Preso da: NYU.Edu
- Wikipedia (2018). Elettronegatività. Tratto da: è.Wikipedia.org

