Caratteristiche degli elettrodi di riferimento, funzione, esempi
- 4060
- 1226
- Baldassarre Ross
Lui Elettrodo di riferimento È un dispositivo che viene utilizzato in analisi potenziometrica e voltamétrica per la determinazione quantitativa di un analita. La sua importanza è, come suggerisce il nome, servire da riferimento per stimare il vero valore del potenziale nella reazione di un semi -elk elettrochimico.
I potenziali di un semi -media dipendono dalla concentrazione di uno ione nell'interesse, poiché reagisce vincendo o perdendo elettroni. In questo modo, è possibile determinare la loro concentrazione attraverso questi potenziali. Tuttavia, i loro valori non sono assoluti ma correlati all'elettrodo di idrogeno standard (lei in inglese).
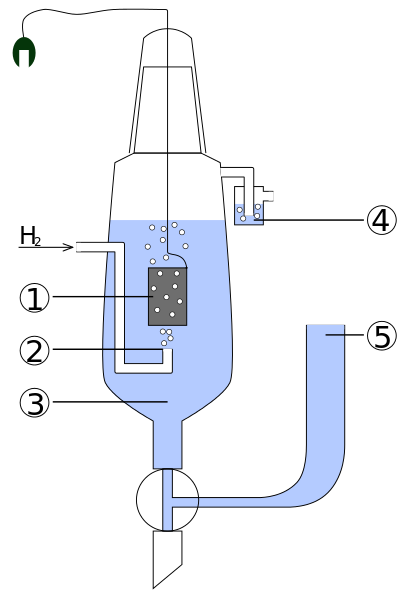
 Diagramma delle parti di un elettro di idrogeno standard. Fonte: standard_hydrogen_electrode.JPG: lavoro kaverdervevevative: Henry Muelpfordt/CC BY-S (http: // creativeCommons.Org/licenze/by-sa/3.0/)
Diagramma delle parti di un elettro di idrogeno standard. Fonte: standard_hydrogen_electrode.JPG: lavoro kaverdervevevative: Henry Muelpfordt/CC BY-S (http: // creativeCommons.Org/licenze/by-sa/3.0/) Per convenzione, i potenziali degli elettrodi di idrogeno sono uguali a 0V. Il problema è che questi elettrodi sono difficili da manipolare, quindi non sono pratici per installarli in tutte le analisi. È qui che entrano gli elettrodi di riferimento, molto più semplici e il cui potenziale è diverso da 0V.
Alcuni degli elettrodi di riferimento, come l'elettrodo saturo di Calomel (ESC), possono essere costruiti nello stesso laboratorio prima che l'analisi venga eseguita. Allo stesso modo, sono ottenuti apertamente sul mercato con le loro specifiche adeguate e i rischi di contaminare il campione dell'analita sono minimi.
[TOC]
Caratteristiche dell'elettrodo di riferimento
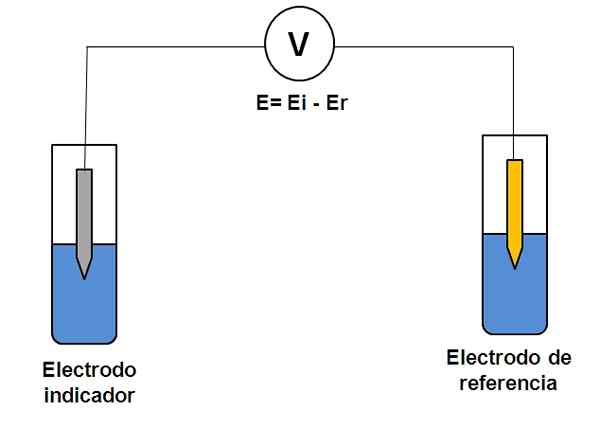 Rappresentazione semplice di un sistema a due elettrodi in potenziometria. Fonte: Gabriel Bolívar.
Rappresentazione semplice di un sistema a due elettrodi in potenziometria. Fonte: Gabriel Bolívar. Considera il sistema di due elettrodi sopra. Uno è l'indicatore (grigio), in cui avviene la reazione di interesse e l'altro è il riferimento (oro). Questa cella elettrochimica avrà un potenziale e, che sarà uguale alla differenza dei potenziali di entrambi gli elettrodi (EI-E). Pertanto, qualsiasi variazione in E deve essere dovuta al potenziale dell'elettrodo indicatore.
Può servirti: cianuro di potassio (KCN): proprietà, usi, strutture, rischi,Da quanto sopra si è concluso che l'elettrodo di riferimento ha le seguenti caratteristiche:
-Ha un potenziale stabile durante il tempo ed è riproducibile. Cioè, dovrebbe essere lo stesso indipendentemente da dove o quante volte vengono effettuate le misurazioni.
-La sua composizione chimica è costante e insensibile, quindi difficilmente subisce cambiamenti quando interagisce con la soluzione dell'analita o si immerge in un mezzo acquoso.
-È facile da costruire e montare, a differenza dell'elettrodo di idrogeno standard, che richiede l'uso di un serbatoio di idrogeno e esegue i rischi di esplosione quando l'idrogeno si mescola con l'aria con l'aria.
L'elettrodo indicatore è sensibile alla concentrazione dell'analita.
Funzione dell'elettrodo di riferimento
I potenziali degli elettrodi di riferimento sono misurati rispetto all'elettrodo di idrogeno standard, quindi i loro valori sono diversi da 0 V. Grazie a questi elettrodi di idrogeno, è possibile la costruzione delle tabelle potenziali standard standard eº, che appaiono nei testi di chimica per le sinfine delle reazioni redox.
Tuttavia, in pratica non sta caricando un elettrodo idrogeno ovunque. Invece, vengono utilizzati elettrodi di riferimento, molto più semplici e in sicurezza per manipolare.
Poiché i suoi potenziali sono costanti e stabili, le potenziali letture della cella elettrochimica sono dovute esclusivamente all'elettrodo indicatore; cioè, alle variazioni della concentrazione dell'analita in questione.
Pertanto, la funzione dell'elettrodo di riferimento è determinare il potenziale di qualsiasi reazione in uno dei semi -limiti del sistema elettrochimico. Se i loro potenziali non fossero stabili, le determinazioni quantitative dell'analita non sarebbero affidabili. Qualsiasi analisi potenziometrica o voltametrica dovrebbe specificare quale elettrodo di riferimento ha usato per segnalare i loro risultati.
Può servirti: acido bromoso (HBRO2): proprietà fisiche e chimiche e usiEsempi di elettrodi di riferimento
Ci sono diversi elettrodi di riferimento disponibili sul mercato. Alcuni usati per determinazioni molto specifiche. Tuttavia, ci sono due elettrodi tra tutti quelli che si distinguono grazie alla loro semplicità e praticità: l'elettrodo di Calomel e l'argento-cloroide, entrambi molto ricorrenti in molte analisi potenziometriche e voltamletriche.
Elettrodo Calomel
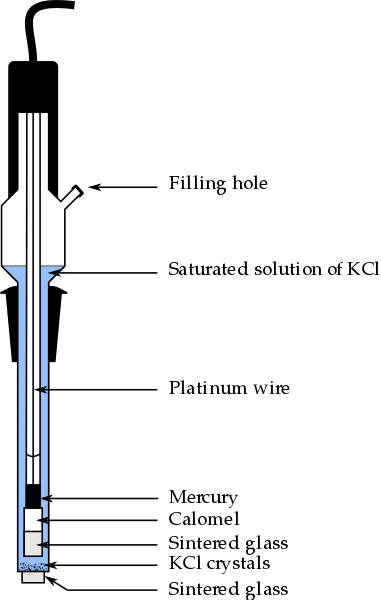 Parti dell'elettrodo Calomel, uno degli elettrodi di riferimento più utilizzati nella chimica analitica. Fonte: Bachi-Bouzouk via Wikipedia.
Parti dell'elettrodo Calomel, uno degli elettrodi di riferimento più utilizzati nella chimica analitica. Fonte: Bachi-Bouzouk via Wikipedia. Nell'immagine superiore sono mostrate le parti convenzionali di un elettrodo di calomel saturo, ECS. Si dice che sia saturo perché contiene una soluzione satura di KCl (blu), che presenta anche dischiuzioni di KCL.
La colonna interna, percorsa da un filo di platino, è piena di mercurio, che a sua volta contatta una pasta di calomel, HG2Cl2 o Mercury cloruro (I) e la soluzione satura di KCl. Pertanto, in questo elettrodo la concentrazione degli ioni cl è importante-, Poiché il suo valore modifica il potenziale dell'elettrodo.
La reazione che ha luogo è la seguente:
Hg2Cl2(s) + 2e- ⇌ 2Hg (L) + 2Cl-
E ha un eº di 0.241 v.
All'estremità inferiore dell'ECS c'è un fritto poroso, che viene messo a contatto elettrico con la soluzione dell'analita e consente lo scambio controllato di ioni ioni-. Altrimenti, ci sarebbe contaminazione dei cloruri nel campione e anche l'elettrodo perderebbe la sua preziosa soluzione KCL satura.
Questo elettrodo viene utilizzato per le misurazioni del pH e in generale di qualsiasi analita la cui concentrazione può essere determinata in un mezzo acquoso.
Può servirti: alcol termico: struttura, proprietà, rischi e usiElettrodo d'argento argento
 Silver Silver Electro. Fonte: tenofalltrades (talk) (uploads). / Dominio pubblico
Silver Silver Electro. Fonte: tenofalltrades (talk) (uploads). / Dominio pubblico Simile all'elettrodo di Calomel, l'elettrodo d'argento è costituito da un filo d'argento coperto di cloruro d'argento e immerso anche in una soluzione satura da una miscela di KCl e AGCL.
Tutte le sue parti sono protette all'interno di un tubo di plastica, che ha un'apertura porosa attraverso la quale stabilisce un contatto elettrico con la soluzione.
La reazione che definisce il suo potenziale, eº = 0.197 V, è il seguente:
AgCl (S) + E- ⇌ AG (S)+CL-
Questo elettrodo presenta maggiori usi e preferenze di quello di Calomel, che è dovuto all'impatto negativo del mercurio sull'ambiente. D'altra parte, gli elettrodi argento con argento sono più semplici, sicuri ed economici da costruire in laboratorio.
Diciamo quindi che l'assolo di elettrodi d'argento sostituisce Calomel in molte delle sue applicazioni (gradi potenziometrici, test di corrosione, analisi elettrochimica, ecc.).
È anche una delle opzioni preferite in biologia e medicina, in particolare per l'elettrocardiografia e l'elettroencefalografia, poiché l'argento o il loro sale sono sostanze relativamente tossiche per il corpo.
Riferimenti
- Giorno, r., & Underwood, a. (1965). Chimica analitica quantitativa. (Quinto ed.). Pearson Prentice Hall.
- Skoog d.A., Ovest d.M. (1986). Analisi strumentale. (Secondo ed.). Inter -American., Messico.
- Wikipedia. (2020). Riferimento elettrodo. Recuperato da: in.Wikipedia.org
- Elsevier b.V. (2020). Riferimento elettrodo. Scienceirect. Estratto da: ScienceDirect.com
- Chimica librettexts. (9 giugno 2020). Elettrodi di riferimento. Recuperato da: Chem.Librettexts.org
- « Alessandria Lighthouse Posizione, storia, descrizione, rovine
- Emily Dickinson Biografia, risultati, opere, frasi »

