Clausius-Clapeyron Equation a cosa serve, esempi, esercizi

- 1308
- 140
- Dott. Rodolfo Gatti
IL Equazione di Clausius-Clapeyron È uno che mette in relazione le variazioni della pressione del vapore e della temperatura, in una fase o di cambio di transizione dello stato. Si applica per sublimazioni, evaporazioni, fusioni o persino nei cambiamenti nelle fasi cristalline. Vale la pena ricordare che questa equazione si applica a una sostanza pura che è in equilibrio.
Questa equazione deriva dalle leggi termodinamiche e dai diagrammi P-T per una sostanza, dove si osserva la linea di coesistenza; Ciò che separa due fasi diverse (vapore liquido, liquido solido, ecc.). Per trasferire questa linea, è necessario guadagno o perdita di calore, come l'entalpia di vaporizzazione, ΔHVAP.
 Equazione di Clausius-Clapeyron. Fonte: Gabriel Bolívar.
Equazione di Clausius-Clapeyron. Fonte: Gabriel Bolívar. L'immagine più alta mostra l'equazione di Clausius-Clapeyron prima di essere integrata. Normalmente viene solitamente applicato ai sistemi di vapore liquido, dove viene utilizzato ΔHVAP e vuoi calcolare quale sarà la pressione del vapore liquido a una certa temperatura. Serve anche a calcolare il ΔHVAP di un certo liquido in un intervallo di temperatura.
L'equazione di Clausisu-Claperon è anche utilizzata abbastanza frequentemente per studiare i cambiamenti di pressione nei solidi volatili; Cioè, viene considerata l'entalpia di sublimazione, ΔHsub.
[TOC]
A cosa è l'equazione di Clausisu-Clapeyron?
Calcolo delle pressioni di pressioni e entalpie di vaporizzazione
Dall'equazione di Clausius-Clapeyron dall'alto, vengono finalmente fatte alcune considerazioni matematiche per eseguire un'integrazione. Ad esempio, per un sistema di vapore liquido, si presume che ΔHVAP Non varia con la temperatura e che ΔV corrisponde esclusivamente al volume del vapore, disprezzando il volume del liquido (Vvapore-Vliquido = Vvapore).
Supponendo che il vapore si comporti come un gas ideale e l'integrazione, si ottiene l'equazione di Clausius-Clapeyron:
Può servirti: volatilizzazione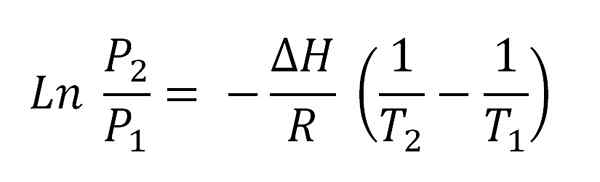 Clausius-Clapeyron Equation integrata.
Clausius-Clapeyron Equation integrata. Questa equazione corrisponde a quella di una linea che è grafica come:
Ln p vs 1/t
E la cui pendenza negativa è (ΔH/R). Per soddisfare questa equazione, quindi, ΔH deve essere costante nell'intervallo di temperatura (t2-T1) in cui le pressioni del vapore sono misurate in equilibrio con il liquido.
In questo modo, se si presume che ΔH varia poco all'interno di piccoli intervalli di temperatura, è possibile utilizzare l'equazione di questa linea per prevedere i cambiamenti nella pressione del vapore di un liquido; E ancora di più, puoi determinare il suo ΔH di vaporizzazione.
Più grandi sono considerati gli intervalli di temperature, maggiore è la deviazione di questa equazione dei dati sperimentali e meno sarà soddisfatto.
Determinazione dei cambiamenti di fase
Pertanto, l'equazione di Clausius-Clapeyron diventa lo sviluppo di una linea tangente alla linea di coesistenza tra due fasi fisiche, che si osserva in qualsiasi diagramma P-T per una sostanza.
Se si verifica un cambiamento di fase, ci sarà un cambiamento sul pendio e ΔH non sarà lo stesso. Pertanto, quando vengono evidenziate forti deviazioni e l'equazione fallisce, è un segno che nell'intervallo di temperatura la sostanza sta vivendo un altro cambiamento di fase. Cioè, cessa di essere un sistema di vapore liquido, poiché viene passato alla linea di coesistenza corrispondente al bilanciamento del liquido solido o del vapore solido.
Usa esempi
- L'equazione di Clausius-Claperon è stata utilizzata in meteorologia per studiare il comportamento delle nuvole, anche quelle presenti su altri pianeti o lune con atmosfere.
Può servirti: acido gluconico: struttura, proprietà, sintesi, usi- È stato usato per determinare l'entalpia di fusione di diversi metalli come sodio e gallio e per estrapolare le loro pressioni di vapore a temperature molto elevate.
- È stato anche usato per determinare l'entalpia di vaporizzazione di sostanze come cloro gassoso, tetracloruro di carbonio, acqua liquida, ghiaccio e iodio.
- Ha anche servito a studiare i cambiamenti di fase nelle strutture cristalline. In quest'ultimo esempio, l'equazione integrata di Clausius-Clapeyron sembra straordinariamente diversa, poiché le stesse considerazioni prese per il sistema di vapore liquido non possono essere fatte per ΔV. Le variazioni del volume da una fase all'altra questa volta sono piccole.
Esercizi risolti
- Esercizio 1
La pressione del vapore di ghiaccio è 4.58 torr a 0 ° C e 1.95 torr a -10 ° C. Qual è la tua entalpia di sublimazione in quell'intervallo di temperatura?
Si noti che abbiamo due pressioni e due temperature:
P1 = 4.58 Torr
P2 = 1.95 Torr
T1 = 0 ° C + 273 = 273 K
T2 = -10 ° C + 273 = 263 K
Convertiamo le unità di temperatura da ° C a K, perché la costante R di gas ha k nelle sue unità:
R = 8.314 J/K
Pertanto, utilizziamo l'equazione integrata di Clausius-Clapeyron e Clear ΔHsub, che rimarrebbe come:
ΔHsub = -Rln (P2/P1) / (1 / t2 - 1 /t1)
Per un maggiore comfort procederà a sostituire solo con i numeri, ma sapendo che l'unità finale sarà la Joule:
ΔHsub = -(8.314) LN (1.95/4.58)/(1/263 - 1/273)
= 50.97 J
O 51.07 j considerando pochi decimali. Questo valore presenterà oscillazioni a seconda degli intervalli t2-T1 e di alcune pressioni a vapore.
- Esercizio 2
Il punto bollente di etanolo a una pressione di 760 torr (1 atm) è 78.3 ° C e la sua entalpia di vaporizzazione è 39.3 kj. Quale sarà la pressione del vapore a una temperatura di 46 ° C?
Può servirti: Tantalo: struttura, proprietà, usi, ottenendoIdentifichiamo i dati:
P1 = 760 Torr
P2 = ?
T1 = 78.3 ° C + 273 = 351.3 k
T2 = 46 ° C + 273 = 319 K
ΔHVAP = 39.3 kJ o 39300 J
Quindi, dobbiamo cancellare P2 dell'equazione integrata di Clausius-Clapeyron. Ancora una volta, le unità saranno omesse per il comfort e i calcoli saranno sviluppati passo dopo passo:
Ln (p2/P1) = -(ΔHVAP/R) (1/t2 - 1/t1)
Ln (p2/760) = -(39300/8.314) (1/319 - 1/351.3)
Ln (p2/760) = -1.36
Applicando la funzione esponenziale su entrambi i lati dell'equazione per poter cancellare P2 avremo:
E (ln p2/760) = E(-1.36)
P2/760 = 0.256
P2 = 0.256 (760)
= 195 Torr
A una temperatura più bassa (46 ° C), una pressione a vapore inferiore (195 torr). In effetti, avere l'etanolo una pressione di 760 torr a 78.3 ° C, stiamo parlando del suo normale punto di ebollizione. Questo è il comportamento previsto per tutti i liquidi
In generale, gli esercizi di Clausius-Claperonico di questo tipo consistono nella pulizia P2, T2 o ΔH di vaporizzazione o sublimazione. I calcoli cambiano in modo significativo quando dovrebbe essere considerato anche ΔV, specialmente quando si tratta di sistemi o saldi solidi-liquidi.
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- Wikipedia. (2020). Relazione Clausius-Claperon. Recuperato da: in.Wikipedia.org
- San José State University. (S.F.). L'equazione di Clausius-Claperon:
Derivazione e applicazione delle IST in meteorologia. Recuperato da: SJSU.Edu - Gruppo Bodner. (S.F.). L'equazione di Clausius-Claperon. Estratto da: Cheded.Chimica.Purdue.Edu
- Chieh c. & Censulo a. (18 maggio 2020). Equazione di Clausius-Clapeyron. Chimica librettexts. Recuperato da: Chem.Librettexts.org
- Walter J. Moore. (1962). Chimica fisica. (Quarta edizione). Longmans.
- « 7 poesie sull'ambiente degli autori noti
- Apprendimento per la teoria della scoperta, esempi, attività »

