Differenze tra composti organici e inorganici

- 1836
- 143
- Brigitta Ferrari
IL Differenze tra composti organici e inorganici Non sono sempre semplici, né obbediscono a una regola immutabile, perché in termini di chimica ci sono sinfine di eccezioni che contraddicono o mettono in discussione le conoscenze precedenti. Tuttavia, ci sono caratteristiche che consentono di discernere tra molti composti che o meno inorganici.
Per definizione, la chimica organica è lo studio che include tutti i rami della chimica del carbonio; Pertanto, è logico pensare che i loro scheletri siano composti da atomi di carbonio. D'altra parte, gli scheletri inorganici (senza entrare nei polimeri) sono generalmente costituiti da qualsiasi altro elemento della tavola periodica diversa dal carbonio.
Gli esseri viventi, su tutte le loro scale ed espressioni, sono praticamente realizzati in carbonio e altri eteroátomos (H, O, N, P, S, ecc.). Quindi tutto il verde che copre la crosta terrestre, così come le creature che ci camminano, sono esempi viventi di composti organici mescolati complessi e dinamicamente.
D'altra parte, perforando la terra e in montagna troviamo ricchi corpi minerali nella composizione e nelle forme geometriche, che nella loro stragrande maggioranza sono composti inorganici. Quest'ultimo definisce anche quasi interamente l'atmosfera che respiriamo e gli oceani, i fiumi e i laghi.
Composti organici | Composti inorganici | |
Atomi che lo compongono | Contengono atomi di carbonio. | Sono costituiti da elementi diversi dal carbonio. |
Fanno parte di .. | Fanno parte degli esseri viventi. | Fanno parte degli esseri inerti. |
Fonti in cui sono | Sono meno abbondanti nelle fonti naturali. | Sono più abbondanti nelle fonti naturali. |
Tipi di composti | Di solito sono molecolari. | Di solito sono ionici. |
Tipi di collegamenti | Collegamenti covalenti. | Collegamenti ionici. |
Masse molari | Masse molari più grandi. | Masse molari inferiori. |
Diversità | Sono meno diversi. | Sono elementi più diversi. |
Fusion e bollitura | Punti di fusione e ebollizione minori. | Punti di fusione e bollitura più elevati. |
Le principali differenze tra composti organici e inorganici
I composti inorganici sono ottenuti da fonti naturali più abbondanti di quelli dei composti inorganici
 Cristalli di zucchero (a destra) e sale (a sinistra) visti al microscopio. Fonte: Oleg Panichev [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)]
Cristalli di zucchero (a destra) e sale (a sinistra) visti al microscopio. Fonte: Oleg Panichev [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] Sebbene ci possano essere eccezioni, i composti inorganici sono generalmente ottenuti da fonti naturali più abbondanti di quelle per i composti organici. Questa prima differenza porta a una dichiarazione indiretta: i composti inorganici sono più abbondanti (sulla terra e nel cosmo) rispetto ai composti organici.
Naturalmente, in un sito petrolifero, predominerà gli idrocarburi e il relativo predominato, che sono composti organici.
Tornando alla sezione, può essere menzionato al sale di zucchero come esempio. I cristalli di zucchero (più robusti e sfaccettati) e il sale sono mostrati sopra (più piccoli e arrotondati).
Lo zucchero si ottiene, dopo una serie di processi, dalle piantagioni di canna da zucchero (nelle regioni soleggiate o tropicali) e dalle barbabietole da zucchero (nelle regioni fredde o all'inizio di inverni o autunno). Entrambi sono materie prime naturali e rinnovabili, che vengono coltivate fino al loro corretto raccolto.
Può servirti: standardizzazione delle soluzioniNel frattempo, il sale proviene da una fonte molto più abbondante: il mare, o laghi e sali come Halita Mineral (NaCl). Se tutte le barbabietole da zucchero e zucchero fossero raccolte, non potrebbero mai eguagliare le riserve di sale naturale.
I cristalli inorganici sono generalmente ionici mentre i cristalli organici tendono ad essere molecolari
Prendendo di nuovo la coppia di zucchero esaltatore come esempio, sappiamo che lo zucchero è costituito da un disaccaride chiamato saccarosio, che a sua volta si disintegra in un'unità di glucosio e un'altra di fruttosio. I cristalli di zucchero sono molecolari, poiché sono definiti dal saccarosio e dai loro ponti idrogeno intermolecolari.
Nel frattempo, i cristalli di sale costituiscono una rete di nazione nata+ e cl-, che definisce una struttura cubica centrata sui volti (FCC).
Il punto centrale è che i composti inorganici di solito formano cristalli ionici (o almeno, in possesso di un carattere ionico alto). Tuttavia, ci sono diverse eccezioni, come i cristalli di CO2, H2S, così2 e altri gas inorganici, che si solidificano a basse temperature e pressioni elevate, e sono anche molecolari.
L'acqua rappresenta l'eccezione più importante a questo punto: il ghiaccio è un cristallo inorganico e molecolare.
 I pochi neve o ghiaccio sono cristalli d'acqua, eccellenti esempi di cristalli molecolari inorganici. Fonte: Sieverschar de Pixabay.
I pochi neve o ghiaccio sono cristalli d'acqua, eccellenti esempi di cristalli molecolari inorganici. Fonte: Sieverschar de Pixabay. I minerali sono in sostanza composti inorganici e i loro cristalli sono quindi prevalentemente ionici. Questo è il motivo per cui questo secondo punto è considerato valido per un ampio spettro di composti inorganici, tra cui sali, solfuri, ossidi, telluri, ecc.
Il tipo di collegamento che governa nei composti organici è covalente
Gli stessi cristalli di zucchero e sale lasciano qualcosa di domanda: i primi contengono collegamenti covalenti (direzionali), mentre il secondo mostra i collegamenti ionici (non direzionali) (non direzionali).
Questo punto è direttamente correlato al secondo: un cristallo molecolare deve necessariamente avere più legami covalenti (che condividono un paio di elettroni tra due atomi).
Ancora una volta, i sali organici stabiliscono alcune eccezioni, poiché hanno anche un carattere fortemente ionico; Ad esempio, benzoato di sodio (C6H5Pata) è un sale organico, ma all'interno del benzoato e il suo anello aromatico ci sono legami covalenti. Anche così, si dice che i loro cristalli siano ionici data l'interazione elettrostatica: C6H5COO- N / a+.
Nei composti organici prevalegano legami covalenti tra atomi di carbonio
O cosa è lo stesso da dire: i composti organici sono costituiti da scheletri gassati. In essi c'è più di un legame C-C o C-H e questo scheletro può essere lineare, strano o ramificato, che varia nel grado di insaturazione e nel tipo di sostituente (eteroaátomos o gruppi funzionali). Abbondano i collegamenti Sugar, C-C, C-H e C-OH.
Può servirti: riduzione dell'agente: concetto, gli esempi più fortiMettiamo come esempio il CO, Ch2Och2 e h2C2O4. Quali di questi tre composti sono inorganici?
Pollice2Och2 (biossido di etilene) ci sono quattro legami C-H e due collegamenti C-O, mentre in H2C2O4 (acido ossalico) Ci sono un C-C, due C-OH e due C = O. La struttura di H2C2O4 Può essere scritto come Hooc-Cooh (due gruppi carbossilici collegati). Nel frattempo, il CO è costituito da una molecola di solito rappresentata con un legame ibrido tra C = O e C /o.
Poiché nel CO (monossido di carbonio) c'è solo un atomo di carbonio legato a uno di ossigeno, questo gas è inorganico; Gli altri composti sono organici.
I composti organici di solito hanno masse molari più grandi
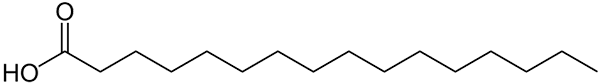 Struttura rappresentata con linee di acido palmitico. Si può notare la cosa grande che viene paragonata ai composti inorganici più piccoli o al peso della formula dei suoi sali. Fonte: Wolfgang Schaefer [dominio pubblico]
Struttura rappresentata con linee di acido palmitico. Si può notare la cosa grande che viene paragonata ai composti inorganici più piccoli o al peso della formula dei suoi sali. Fonte: Wolfgang Schaefer [dominio pubblico] Ancora una volta, ci sono numerose eccezioni a queste regole, ma di solito i composti organici tendono ad avere masse molari più grandi a causa del loro scheletro carbonizzato.
Ad esempio, i molari dei composti di cui sopra sono: 28 g/mol (CO), 90 g/mol (H2C2O4) e 60 g/mol (scegli2Och2). Certo, il CS2 (Disolfuro di carbonio), composto inorganico e la cui massa molare è 76 g/mol, "pesa" più di Cho2Och2.
Ma che dire dei grassi o degli acidi grassi? Di biomolecole come DNA o proteine? O di ampi idrocarburi a catena lineare? O asfaltene? Le sue masse molari superano facilmente i 100 g/mol. L'acido palmitico (immagine superiore), ad esempio, ha un impasto molare da 256 g/mol.
I composti organici sono più abbondanti in numero
Alcuni composti inorganici, chiamati complessi di coordinamento, presentano Isomeía. Tuttavia, questo è meno diversificato rispetto all'isomeria organica.
Anche se aggiungiamo tutti i sali, gli ossidi (metallici e non metallici), solfuri, telururos, carburi, idruri, nitruri, ecc., Non avremmo raccolto forse nemmeno la metà dei composti organici che potrebbero esistere in natura. Pertanto, i composti organici sono più abbondanti in numero e più ricchi nelle strutture.
I composti inorganici sono elementari più diversi
Tuttavia, secondo la diversità elementare, i composti inorganici sono più vari. Perché? Perché con la tabella periodica nella mano puoi costruire qualsiasi tipo di composto inorganico; Mentre un composto organico è limitato solo agli elementi: C, H, O, P, S, N e X (alogeni).
Abbiamo molti metalli (alcalini, alcalini, transizione, lantanidi, actinidi, quelli del blocco P) e infinito di opzioni per combinarli con diversi anioni (inorganici ordinari); come: co32- (Carbonati), CL- (Cloruri), p3- (fosfuros), o2- (ossidi), oh- (idrossidi), così42- (Solfati), CN- (cianidi), SCN- (Tiociati) e molti altri.
Si noti che gli anioni CN- e scn- Sembrano essere organici, ma in realtà sono inorganici. Un'altra confusione è l'anione ossalato, c2O42-, che è organico e non inorganico.
Può servirti: regola diagonaleI composti inorganici hanno punti di fusione e bollitura più elevati
Ancora una volta, ci sono diverse eccezioni a questa regola, poiché tutto dipende da quale coppia di composti viene confrontato. Tuttavia, attenersi a sali inorganici e organici, i primi di solito hanno una maggiore fusione e punti di ebollizione rispetto al secondo.
Qui troviamo un altro punto implicito: i sali organici sono suscettibili alla decomposizione, perché il calore rompe i suoi legami covalenti. Anche così, confrontiamo il parto di calcio (CAC4H4O6) e carbonato di calcio (Caco3). Il CAC4H4O6 Si decompone a 600 ° C, mentre il Caco3 Si scioglie a 825 ° C.
E che il caco3 è lungi dall'essere uno dei sali con i punti di fusione più alti, come nei casi del CAC2 (2160 ºC) e CAS2 (2525 ºC): carburo e solfuro di calcio, rispettivamente.
I composti organici sono più rari nell'universo
I composti organici più semplici e primitivi, come il metano, Cho4, Urea, CO (NH2)2, o l'amminoacido glicina, NH2Cap2COOH, sono specie molto rare nel cosmo rispetto a ammoniaca, anidride carbonica, ossidi di titanio, carbone, ecc. Nell'universo anche i materiali precursori della vita non vengono spesso rilevati.
I composti organici supportano la vita in misura molto maggiore rispetto a inorganico
 Il guscio di un morocoo è costituito da una miscela di ossa coperte da cheratina, che sono composte da una matrice inorganica (idrossiapatite e minerali correlati) e organici (collagene, cartilagine e nervi). Fonte: Morrocoy_ (geochelone_carbonary).JPG: la fotografia.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]
Il guscio di un morocoo è costituito da una miscela di ossa coperte da cheratina, che sono composte da una matrice inorganica (idrossiapatite e minerali correlati) e organici (collagene, cartilagine e nervi). Fonte: Morrocoy_ (geochelone_carbonary).JPG: la fotografia.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)] La chimica del carbonio, organico, applicata nella comprensione dei processi metabolici, diventa biochimica (e dal punto di vista dei cationi metallici, in bioinorganico).
I composti organici sono la pietra angolare della vita (come il Morrocoy dell'immagine superiore), grazie ai collegamenti C-C e all'enorme conglomerato di strutture derivanti da questi collegamenti e alla sua interazione con cristalli di sali inorganici.
Tornando alla coppia di sale di zucchero, le fonti naturali dello zucchero sono vive: sono colture che si sviluppano e muoiono; Ma non accade lo stesso con le fonti del sale: i sedi o i depositi salini sono vivi (in senso fisiologico).
Le piante e gli animali sintetizzano infiniti composti organici, che integrano una vasta gamma di prodotti naturali (vitamine, enzimi, ormoni, grassi, coloranti, ecc.).
Tuttavia, non possiamo lasciare fuori il fatto che l'acqua è il solvente della vita (ed è inorganico); Né quell'ossigeno è indispensabile per la respirazione cellulare (senza nominare cofattori metallici, che non sono composti inorganici ma cationi). Pertanto, anche inorganico svolge un ruolo cruciale nella definizione di vita.
Riferimenti
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- Graham Solomons t.W., Craig b. Frigorifero. (2011). Chimica organica. Ammine. (10a edizione.). Wiley Plus.
- Helmestine, Anne Marie, PH.D. (3 luglio 2019). La differenza tra organico e inorganico. Recuperato da: Thoughtco.com
- Texas Education Agency. (2019). Organico o inorganico? Recuperato da: Texasgateway.org
- Saccarosio. (S.F.). Come viene preparato lo zucchero: un'introduzione. Recuperato da: sucrosa.com
- Wikipedia. (2019). Elenco dei composti inorganici. Recuperato da: in.Wikipedia.org
- « Differenze tra velocità e velocità (con esempi)
- 10 dinamiche di intelligenza emotiva per bambini e adulti »

