Derivati alogenati

- 3906
- 1188
- Dante Morelli
Spieghiamo quali sono i derivati alogenati, le loro proprietà, usi/applicazioni e diamo diversi esempi
Quali sono i derivati alogenati?
IL Derivati alogenati Sono tutti composti che hanno un atomo alogeno; cioè uno qualsiasi degli elementi del gruppo 17 (f, cl, br, i). Questi elementi differiscono dal resto perché sono più elettronegativi, formando una diversità di alogenuri inorganici e organici.
L'immagine inferiore degli alogeni è mostrata nell'immagine inferiore. Dall'alto verso il basso: fluoro (f2), Cloro (CL2), Bromo (BR2) e iodio (i2). Ognuno di questi ha la capacità di reagire con la stragrande maggioranza degli elementi, anche tra congeneri dello stesso gruppo (Interhalogens).

Pertanto, i derivati alogenati hanno una formula MX se si tratta di un haluro di metallo, Rx se è alchil e ARX se è aromatico. Gli ultimi due si trovano nella categoria Organic Haluros. La stabilità di questi composti richiede un "beneficio" di energia davanti alla molecola di soda originale.
Come regola generale, il fluoro si forma alogenato più stabile dello iodio. Il motivo è dovuto alle differenze tra le loro radio atomiche (le sfere viola sono più voluminose di quelle gialle).
Aumentando il raggio atomico, la sovrapposizione degli orbitali tra l'alogeno e l'altro atomo è più povera e, quindi, il collegamento è più debole.
Nomenclatura
Il modo per nominare correttamente questi composti dipende dal fatto che siano inorganici o organici.
Inorganico
Gli alogenuri metallici sono costituiti da un legame, ionico o covalente, tra un metallo alogeno e un metallo (dei gruppi 1 e 2, metalli di transizione, metalli pesanti, ecc.).
In questi composti tutti gli alogeni hanno uno stato di ossidazione di -1. Perché? Perché le sue configurazioni di Valencia sono NS2Np5.
Pertanto, devono vincere un solo elettrone per completare l'ettetto di Valencia, mentre i metalli si ossidano, dando loro gli elettroni che hanno.
Può servirti: equilibrio di precisione: caratteristiche, funzioni, parti, usiPertanto, il fluoro rimane come F-, fluoruro; Il cl-, cloruro; il br-, bromuro; e l'i-, io duro. MF sarebbe nominato: fluoro di (nome metallico) (n), essendo il valencia del metal solo quando ha più di uno. Nel caso di gruppi di gruppi 1 e 2, non è necessario nominare Valencia.
Esempi
- NAF: fluoruro di sodio.
- Cacl2: Cloruro di calcio.
- AGBR: Bromuro d'argento.
- Zni2: Zinc Yoduro.
- CUCL: cloruro di rame (i).
- Cucl2: cloruro di rame (II).
- Ticl4: Cloruro di titanio (IV) o Titano tetracloruro.
Tuttavia, gli elementi di idrogeno e non metal - anche gli stessi alogeni - possono anche formare Haluros. In questi casi il Valencia del non metallo non è nominato alla fine:
- PCL5: fosforo pentacloruro.
- Bf3: Boro trifluoro.
- Ali3: Triyoduro di alluminio.
- HBR: bromuro di idrogeno.
- Se7: iodio eptofluoruro.
Biologico
Indipendentemente dal fatto che Rx o ARX, l'alogeno è legato covalentemente a un atomo di carbonio. In questi casi, gli alogeni sono menzionati con i loro nomi e il resto della nomenclatura dipende dalla struttura molecolare di R o AR.
Per la molecola organica più semplice, metano (Cho4), I seguenti derivati si ottengono sostituendo l'H con Cl:
- Cap3CL: clorometano.
- Cap2Cl2: diclorometano.
- CHCL3: tricolorometano (cloroformio).
- CCL4: Tetraclorometano (cloruro di carbonio (IV) o tetracloruro di carbonio).
Qui R è costituito da un singolo atomo di carbonio. Quindi, per altre catene alifatiche (lineari o rami) il numero di carboni viene conteggiato da cui è collegato all'alogeno:
Cap3Cap2Cap2F: 1-fluorpropano.
L'esempio precedente era quello di un alogenuro alquilica primario. Nel caso in cui la catena sia ramificata, viene scelto il più lungo contenente l'alogeno e inizia a contare, lasciando questo numero possibile:
Può servirti: quali sono le proprietà fisiche della materia?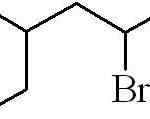
3-metil-5-bromohexan
Allo stesso modo si verifica per altri sostituenti. Inoltre, per gli alogenuri aromatici viene nominato alogeno e quindi il resto della struttura:

L'immagine superiore mostra il composto chiamato bromobenzene, evidenziando l'atomo di bromo in marrone.
Proprietà dei derivati alogenati
Alogenuri inorganici
Gli alogenuri inorganici sono solidi ionici o molecolari, sebbene i primi siano più abbondanti. A seconda delle interazioni e delle radio ioniche di MX, questo sarà solubile in acqua o altri solventi polari.
Gli alogenuri non metallici (come boro) sono di solito acidi Lewis, il che significa che accettano elettroni per formare complessi. D'altra parte, alogenuri (o alogenuri) di idrogeno disciolti in acqua producono quelli che sono noti come idracidi.
I suoi punti di fusione, ebollizione o sublimazione cadono su interazioni elettrostatiche o covalenti tra metallo o non metal con alogeno.
Allo stesso modo, le radio ioniche svolgono un ruolo importante in queste proprietà. Ad esempio, se m+ e x- Hanno dimensioni simili, i loro cristalli saranno più stabili.
Alogenuri organici
Sono polari. Perché? Perché la differenza nelle elettronegatività tra C e alogeno crea un momento polare permanente nella molecola. Inoltre, questo diminuisce quando il gruppo 17 discende, dal collegamento C-F a C-I.
Senza considerare la struttura molecolare di R o AR, i numeri di alogeni in crescita influenzano direttamente i punti di ebollizione, poiché aumentano la massa molare e le interazioni intermolecolari (RC-X-X-CR). La maggior parte sono impossibili con l'acqua, ma possono dissolversi nei solventi organici.
Usi di derivati alogenati
Gli usi dei derivati alogenati potrebbero riservare il proprio testo. I "compagni" molecolari degli alogeni sono un fattore chiave, dato che le loro proprietà e reattività definiscono gli usi del derivato.
Può servirti: solfato di potassio (K2SO4): struttura, proprietà, usi, sintesiPertanto, tra la grande diversità dei possibili usi, si distinguono:
- Gli alogeni molecolari vengono utilizzati per creare lampadine alogene, dove si contattano il filamento di tungsteno a incandescenza. Lo scopo di questa miscela è reagire l'alogeno X con il tungsteno evaporato. In questo modo la sua deposizione è evitata sulla superficie del bulbo, garantendo più tempo di vita.
- I sali di fluoro sono usati nella fluorizzazione delle acque dentali e delle paste.
- Gli ipocloriti di sodio e calcio sono due agenti attivi nelle soluzioni di sbiancamento commerciale (cloro).
- Sebbene deteriorano lo strato di ozono, i clorofluorocarburi (CFC) sono utilizzati negli aerosol e nei sistemi di raffreddamento.
- Cloruro di vinile (Cho2= CHCL) è il monomero del cloruro di polimero polivinilico (PVC). D'altra parte, il teflon, usato come materiale non scintillante, è costituito da catene polimeriche di tetrafluoretilene (f2C = cf2).
- Sono usati nella chimica analitica e nella sintesi organica per scopi diversi; Tra questi, la sintesi dei farmaci.
Esempi aggiuntivi

L'immagine superiore illustra l'ormone tiroideo, responsabile della produzione di calore e dell'aumento del metabolismo generale nel corpo. Questo composto è un esempio di un derivato alogenato presente nel corpo umano.
Tra gli altri composti alogenati, vengono menzionati i seguenti:
- Diclorodifenilriclootan (DDT), efficiente insetticida ma con gravi impatti ambientali.
- Cloruro di stagno (snncl2), usato come agente riducente.
- Cloroetano o 1-cloroetano (CH3Cap2Cl), anestetico topico che agisce raffreddando rapidamente la pelle.
- Dicloroetilene (clch = cclh) e tetracloroetilene (CL2C = ccl2), utilizzato come solventi nel settore del lavaggio a secco.
- « Struttura chimica in carburo di silicio, proprietà e usi
- 80 frasi per il primo amore che non dimentica mai »

