Difetti specifici
- 1623
- 458
- Rufo Longo
Quali sono difetti specifici?
I difetti puntuali sono imperfezioni o irregolarità che sono presentate nel reticolo cristallino di un solido e che deviano la struttura cristallina del suo stato perfetto. Si dice che non abbiano una dimensione (0) perché sono solo punti del reticolo cristallino; Questo punto può essere un atomo, ione, molecola, cluster, ecc.
I solidi a una temperatura di 0 K (zero assoluto) mostrano strutture perfette, perché in teoria i suoi componenti sono immobilizzati, congelati. Tuttavia, gli atomi sono a malapena caricati, per dire, iniziano a vibrare, che prima o poi finiscono per muoversi fuori dai loro siti corrispondenti.
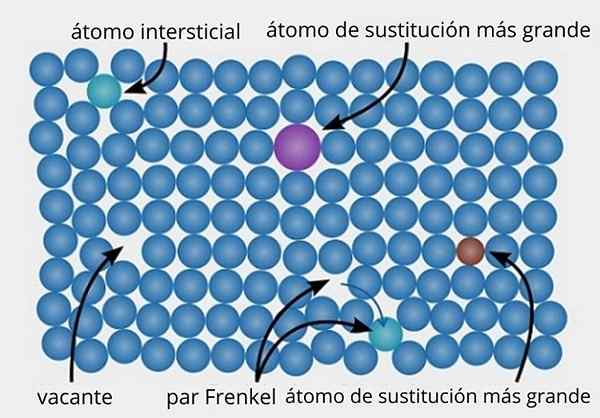
 Rappresentazione di vari tipi di difetti specifici trovati nei solidi cristallini. Fonte: Daniferi, CC BY-SA 3.0, via Wikimedia Commons
Rappresentazione di vari tipi di difetti specifici trovati nei solidi cristallini. Fonte: Daniferi, CC BY-SA 3.0, via Wikimedia Commons Vediamo l'immagine superiore come esempio. In una struttura cristallina ordinata e perfetta, tutti i punti bluastri dovrebbero essere allineati. Tuttavia, alcuni dei punti bluastri possono essere assenti, che si osserva dalla presenza di uno spazio vuoto o da un posto vacante.
Se la formazione di tale posto vacante è dovuta allo spostamento di un punto bluastro del suo sito originale, avremo un paio di Frenkel, uno dei principali tipi di difetti specifici esistenti. Il punto bluastro mobilitato è ora in posizione interstiziale (verde).
D'altra parte, difetti specifici possono anche essere dovuti a sostituzioni, da atomi (viola) più grandi o atomi più piccoli (marroni) (marrone). Parliamo di difetti specifici sostitutivi, che si svolgono molte volte quando le impurità vengono introdotte di proposito (DOPPED) in metallo e materiali ceramici.
I difetti puntuali sono essenziali per comprendere altri difetti proiettati in altre dimensioni del vetro.
Difetti specifici intrinseci
Quando una struttura cristallina è sempre definita, viene sempre fatta per ideale. Ma in natura i difetti sono inevitabili, per quanto piccoli lo siano. Pertanto, i solidi hanno una predisposizione naturale per presentare difetti specifici nelle loro strutture, la cui interazione e somma influenzano o modificano le loro proprietà chimiche e fisiche. I difetti specifici intrinseci così chiamati si svolgono in materiali "puri".
Questa predisposizione naturale è dovuta a fattori termodinamici e cinetici. L'introduzione di difetti aumenta l'entropia del solido, che a sua volta aumenta con la temperatura. Quindi, a una certa temperatura, qualsiasi solido avrà uno stato con una configurazione minima di difetti specifici.
All'aumentare della temperatura, ci saranno ancora più difetti, con la massima quantità possibile in prossimità del punto di fusione. Tutto ciò ha senso se si pensa che a vibrazioni termiche più elevate, maggiore saranno le possibilità che gli atomi abbandonino le rispettive posizioni reticolari.
Punti difetti estrinseci
A differenza di difetti intrinseci specifici, quelli estrinseci si verificano a causa dell'incorporazione delle impurità. Nessun solido in natura è puro al 100%, quindi questi tipi di difetti si manifesteranno sempre, oltre a intrinseci.
Può servirti: acido gluconico: struttura, proprietà, sintesi, usiTuttavia, addebitano un'importanza e un interesse unici quando le impurità vengono aggiunte intenzionalmente in quantità di default; Parliamo del materiale stupido.
A seconda delle caratteristiche del Doponte e del materiale selezionato, i difetti sono incorporati nel solido in modo premeditato, che ha un impatto sulle sue proprietà chimiche e fisiche. Tale è il caso della formulazione di semiconduttori, ad esempio i GAA.
D'altra parte, difetti specifici estrinseci alludono anche a coloro che modificano la composizione di materiali o solidi. Cioè, perdono la loro stechiometria per diventare solidi non -sistoometrici.
Difetti metallici puntuali
Nei metalli abbiamo cristalli che, in linea di principio, mancano di cariche elettriche; Cioè, non ci sono cationi o anioni presenti, ma solo atomi di metallo neutro. Quindi, i difetti che potrebbero essere nei metalli non influenzerebbero la loro neutralità, quindi nessun meccanismo non avrebbe un meccanismo che compensa tali difetti.
 Difetti intrinseci specifici nei cristalli di un metallo ipotetico. Fonte: Gabriel Bolívar.
Difetti intrinseci specifici nei cristalli di un metallo ipotetico. Fonte: Gabriel Bolívar. Nell'immagine sopra abbiamo un cristallo perfetto e altri due con difetti. Gli atomi possono essere posizionati in posizioni interstiziali, che disordinano le posizioni degli atomi vicini ed è noto come un difetto auto-interviziale (sotto al centro). Nel frattempo, alcuni atomi sono in grado di abbandonare i rispettivi siti della disposizione cristallina per generare posti vacanti (a destra).
Pertanto, nei metalli puri è possibile l'esistenza di difetti intrinseci di posti vacanti e auto-interessioni. Più posto vacante lì, la densità della sostanza diminuisce; fatto che è in linea con l'aumento del numero di difetti con la temperatura.
Quando, d'altra parte, viene dato il metallo con atomi di un altro elemento, causano sostituzioni o cercano di mettersi negli interstizi. In tali casi, la densità del metallo aumenta al massimo valore, da cui inizia a diminuire drasticamente.
Difetti specifici nelle strutture cristalline
Nelle strutture cristalline, coprendo altri solidi oltre ai metalli sopra menzionati, abbiamo due tipi principali di difetti specifici: quelli di Frenkel e quelli di Schottky. Entrambi possono verificarsi nelle stesse regioni di un cristallo, ed è anche del tutto possibile che siano presenti insieme a posti di lavoro o difetti interstiziali.
Quando parliamo di sali, ossidi, solfati, ecc., Ci saranno cationi e anioni che definiscono un cristallo per le sue interazioni elettrostatiche. Pertanto, se eliminiamo un catione, i carichi negativi degli anioni predominano e il vetro verrà caricato negativamente. Questo è impossibile accadere perché violate il principio dell'elettroneutralità.
Pertanto, i difetti in questo tipo di cristalli generano cariche elettriche, che per mezzo di un meccanismo devono essere nuovamente abbinate. Tuttavia, i difetti di Frenkel e Schottky non producono questo squilibrio di cariche elettriche.
Può servirti: punto di equivalenzaFrenkel
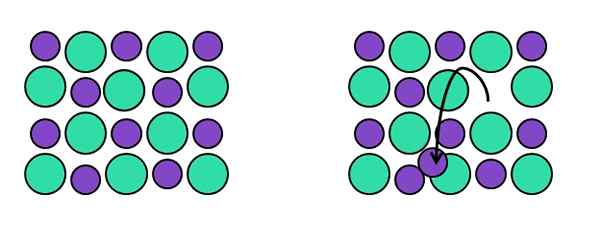 La rappresentazione puntuale del difetto di Frenkel. Fonte: Gabriel Bolívar.
La rappresentazione puntuale del difetto di Frenkel. Fonte: Gabriel Bolívar. Farm -Ran -Time Frenkel, in onore di Yakov Frenkel, un punto reticolare lascia la sua posizione originale per terminare in un interstizio. Cioè, un atomo, molecola o ione si spostano in una posizione interstiziale lasciando dietro di sé un posto vacante.
Vedere l'esempio dell'immagine sopra. A sinistra abbiamo il cristallo perfetto composto da due ioni: uno verde, che ordinari all'anione (più ingombrante) e uno viola, che diventa il catione (più piccolo).
Quando uno dei cationi viola lascia la loro posizione della disposizione cristallina, lascia un posto vacante dietro. Nota a sinistra la direzione in cui la freccia nera punta, sottolineando che il catione si trova ora in un interstizio.
Poiché il difetto di Frenkel è costituito da spostamenti di cationi (o anioni), il vetro rimane neutro. Inoltre, la composizione del vetro rimane costante, poiché nel reticolo gli ioni stanno cambiando posizioni: non la stanno abbandonando, né altri lo aggiungono.
Schottky
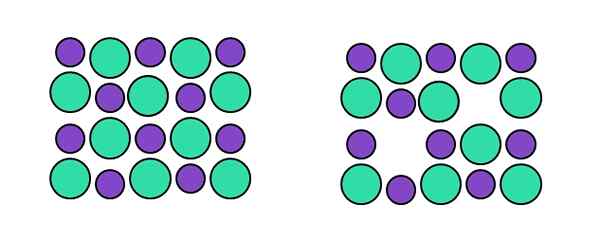 Rappresentazione del difetto di Schottky. Fonte: Gabriel Bolívar.
Rappresentazione del difetto di Schottky. Fonte: Gabriel Bolívar. Nel tipo specifico Schoottky abbiamo due posti vacanti simultanei: uno corrispondente al catione e un altro corrispondente all'anione. Ad esempio, non si tratta di un catione per rangarmi una posizione interstiziale, ma che "scompare" accompagnato da un anione (a destra dell'immagine superiore).
Ancora una volta, quando due posti vacanti vengono creati contemporaneamente, un cationico (che si comporterà come un anione) e un anionico (che si comporterà come un catione), la composizione del cristallo rimane invariata. Questo è così finché questo tipo di difetto si parla e non posti vacanti arbitrari causati da agenti esterni o interni.
Di tutto quanto sopra, si è concluso che i difetti di Frenkel e Shottky sono difetti stechiometrici del punto intrinseco.
Difetti puntuali nei materiali ceramici
Le ceramiche sono materiali il cui carattere ionico è molto oscillante. Alcuni presentano un marcato carattere covalente, come con la silice, SIO2, o con l'alluminio Nitur, Aln.
Pertanto, dobbiamo considerare altri due tipi di difetti specifici che possono verificarsi come prodotto della natura covalente della ceramica: l'antishium e il legame non saturo.
Antisizio
Come suggerisce il nome, è il difetto che si verifica quando due atomi cambiano il loro sito, essendo in posizioni contrarie a quelle del reticolo cristallino originale. Ad esempio, nel SIC può accadere che ci siano C-C o SI-if dove non ci dovrebbero essere. Questo tipo di difetto puntuale è anche molto comune nelle leghe:
Può servirti: alluminio fosfuro (AIP): struttura, proprietà, usi, rischi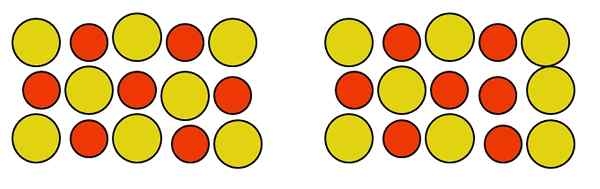 Difetto puntuale di antisium in una lega Au-Cu. Fonte: Gabriel Bolívar.
Difetto puntuale di antisium in una lega Au-Cu. Fonte: Gabriel Bolívar. Si noti che gli atomi di rame e oro nella lega Au-how sono neutri. Non importa come si muovono, la neutralità del vetro non è disturbata. Pertanto, i due atomi cambiano il sito nel vetro, come nella destra dell'immagine sopra, non influisce sulla neutralità della lega.
In ceramiche che hanno più di un catione, come le spins, due cationi con uguale valenze possono scambiare il sito (ad esempio a3+ e cr3+) senza lo squilibrio delle cariche elettriche.
Collegamento non saturo
Il collegamento non saturo (legame penzolante in inglese) interrompe l'ordine nei cristalli della ceramica covalente, poiché l'atomo che forma il collegamento è assente, lasciando un paio di elettroni liberi.
Nella ceramica non solo i difetti di ant -itio e collegamento non saturi sono riportati, ma anche tutti difetti intrinseci ed estrinseci, quindi è complesso analizzare le loro strutture reali e non perfette.
Esempi di difetti specifici
Nel corso dell'articolo sono stati menzionati alcuni esempi di materiali e dei loro difetti specifici. Successivamente, e infine, altri materiali saranno elencati, accompagnati dal tipo di difetto che di solito presentano.
Alogenuri d'argento
Gli alogenuri d'argento, come AgCl o AGBR, presentano difetti di Frenkel in cui l'Ag Cation+ Si sposta in posizioni interstiziali.
Alcalino alcalino
Gli alogenuri alcalini, come il NaCl, manifestano difetti Schottky, i cui posti vacanti anionici sono riempiti di elettroni quando i loro cristalli sono riscaldati in presenza di vapori di potassio di sodio o metallici.
Biossido di Torio
Nel tho2 Il cation th4+ è più ingombrante dell'anione o2-. Pertanto, questo ossido ha un difetto di frenkel dove si trova o2- che si sposta in posizioni interstiziali.
Paladio Sponge
Il paladio è in grado di assorbire l'idrogeno, comportandosi come una spugna che li conserva nelle posizioni interstiziali dei loro cristalli.
Acciai
Allo stesso modo, come accade tra paladio e idrogeno, il ferro può incorporare atomi di carbonio nei suoi interstizi, il che si traduce nella formazione di acciai.
Leghe di titanio
Il difetto puntuale di sostituzione, sebbene non sia stato spiegato come gli altri difetti, non è altro che la sostituzione di un atomo per un altro, che si rompe con l'ordine stabilito dal cristallo.
Pertanto, ad esempio, gli atomi di un cristallo di titanio possono essere sostituiti da altri atomi (metallici) per causare una famiglia di leghe di titanio.
Riferimenti
- Barry Carter & M. Grant Norton. (2007). Scienza e ingegneria dei materiali in ceramica. Springer.
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- B.S.H. Royce. (S.F.). Difetti puntuali. Recuperato da: Princeton.Edu
- Wikipedia. (2020). Difetto cristallografico. Recuperato da: in.Wikipedia.org
- Nayak, s.K., Appeso, c.J., Sharma, v. et al. (2018). Approfondimento sui difetti e impurità del punto nel titanio dai primi principi.NPJ Computer Ma 4.11. doi.org/10.1038/S41524-018-0068-9
- Byju's. (2020). Difetti puntuali. Recuperato da: byjus.com

