Chrome (CR)

- 1107
- 257
- Brigitta Ferrari
 Chrome è un metallo molto reattivo. Wikimedia Commons
Chrome è un metallo molto reattivo. Wikimedia Commons Cos'è Chrome?
Lui cromo (CR) è un elemento chimico del gruppo 6 (VIB) della tabella periodica. Ogni anno tonnellate di questo metallo sono prodotte mediante estrazione di minerale di cromite o magnesio (FECR2O4, Mgcr2O4), che sono ridotti con carbone per ottenere il metallo. È molto reattivo e solo in condizioni molto riducenti è nella sua forma pura.
I suoi minerali e ossidi, nonché una piccola porzione di rame metallico, fanno occupare questo elemento il numero 22 del più abbondante della corteccia terrestre.
La chimica del cromo è molto diversificata perché può formare collegamenti con quasi l'intera tavola periodica. Ognuno dei suoi composti presenta colori che dipendono dal numero di ossidazione, così come dalle specie che interagiscono con esso.
Inoltre, forma i collegamenti al carbonio, che intervengono in un gran numero di composti organometalici.
Caratteristiche e proprietà cromate
Il cromo è un metallo argento nella sua forma pura, con numero atomico 24 e un peso molecolare di circa 52 g/mol (52Cr, il suo isotopo più stabile).
Dati i suoi forti collegamenti in metallo, presenta punti di fusione (1907 ºC) e ebollizione (2671 ºC) alti. Inoltre, la sua struttura cristallina lo rende un metallo molto denso (7.19 g/ml).
Non reagisce con l'acqua per formare idrossidi, ma con acidi. Si ossida con l'ossigeno dell'aria che generalmente produce ossido cromico, che è un pigmento verde ampiamente usato.
Questi strati di ossido creano ciò che è noto come Passivazione, Proteggere il metallo dalle successive corrosioni, poiché l'ossigeno non può penetrare nel seno metallico.
La sua configurazione elettronica è [ar] 4s13d5, Con tutti gli elettroni mancanti e quindi mostra proprietà paramagnetiche. Tuttavia, l'accoppiamento di spin elettronici può verificarsi se il metallo è soggetto a basse temperature, acquisendo altre proprietà, come l'antiferromagnetismo.
Può servirti: materiali refrattariStruttura cromata chimica
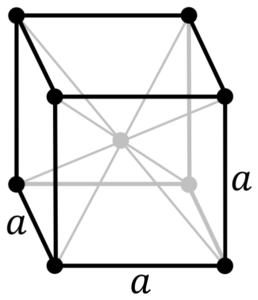 Struttura metallica cromata. Fonte: di PNG originali di Daniel Mayer, DRBOB, Wikimedia Commons
Struttura metallica cromata. Fonte: di PNG originali di Daniel Mayer, DRBOB, Wikimedia Commons Qual è la struttura del metallo cromato? Nella sua forma pura, il cromo adotta una struttura cristallina cubica centrata sul corpo (CC o BCC). Ciò significa che l'atomo cromato si trova al centro di un cubo, i cui bordi sono occupati da altri cromi (come nell'immagine superiore).
Questa struttura è responsabile del cromo che possiede elevati punti di fusione e bollitura, nonché una grande durezza. Gli atomi di rame si sovrappongono agli orbitali S e D per formare bande di guida secondo la teoria della banda.
Pertanto, entrambe le bande sono piene a metà perché la loro configurazione elettronica è [ar] 4s13d5, E come l'orbitale s, può ospitare due elettroni e gli orbitali di dieci. Quindi, solo la metà delle bande formate dalle loro sovrapposizioni sono occupate dagli elettroni.
Con queste due prospettive: la struttura cristallina e il collegamento metallico -molte delle proprietà fisiche di questo metallo possono essere spiegate in teoria. Tuttavia, nessuno dei due spiega perché Chrome può avere diversi stati o numeri di ossidazione.
Per questo, una profonda comprensione della stabilità dell'atomo rispetto ai giri elettronici.
Numero di ossidazione cromata
Perché la configurazione elettronica di Chrome è [AR] 4s13d5 Puoi vincere fino a uno o due elettroni (CR1- e cr2-) o perderli per acquisire numeri di ossidazione diversi.
Pertanto, se il cromo perde un elettrone, sarebbe come [ar] 4s03d5; Se ne perdi tre, [ar] 4s03d3; E se li perdi tutti, [ar], o ciò che è lo stesso, sarebbe isolectronico argon.
Può servirti: punto di ebollizione: concetto, calcolo ed esempiIl cromo non perde o guadagna elettroni a causa del semplice capriccio: ci deve essere una specie che faceva loro o accettarle da un numero di ossidazione a un altro.
Il cromo ha i seguenti numeri di ossidazione: -2, -1, 0, +1, +2, +3, +4, +5 e +6. Di loro il +3, cr3+, È il più stabile e quindi il predominante di tutti; seguito da +6, CR6+.
Chrome usa
Come colorante o pigmento
Il cromo ha una vasta gamma di applicazioni, dal colorante per diversi tipi di tessuti, al protettore che abbellisce le parti metalliche, in quello che è noto come Chrome, che può essere fatto con il metallo puro o con composti CR (III) o CR (Vi).
Fluoro cromico (CRF3), ad esempio, viene usato come colorante per panni di lana; Solfato cromico (CR2(SW4)3), è destinato a color smalti, ceramiche, dipinti, inchiostri, vernici e serve anche ai metalli Chromar; e ossido cromico (CR2O3) Trova anche l'uso in cui è richiesto il suo attraente colore verde.
Pertanto, qualsiasi minerale cromato con colori intensi può essere destinato a tingere una struttura, ma successivamente il fatto che questi composti siano pericolosi o meno per l'ambiente o per la salute degli individui.
In effetti, le sue proprietà velenose sono usate per conservare il legno e altre superfici di attacco degli insetti.
In cromato o metallurgia
Allo stesso modo, vengono aggiunte piccole quantità di cromo in acciaio per rafforzarlo di fronte all'ossidazione e per migliorare la sua luminosità. Questo perché è in grado di formare carburi grigi (CR3C2) Molto resistente quando reagi con l'ossigeno dell'aria.
Può servirti: idrossido di calcio (Ca (OH) 2): struttura, proprietà, ottenimento, usiPoiché il cromo può lucidare fino a superfici luminose, Chrome presenta quindi disegni e colori in argento come alternativa più economica per questi scopi.
Nutrizionale
Alcuni discutono se il cromo può essere considerato un elemento essenziale, cioè indispensabile nella dieta quotidiana. È presente in alcuni alimenti in concentrazioni molto piccole, come foglie verdi e pomodori.
Esistono anche integratori proteici che regolano l'attività dell'insulina e favoriscono la crescita muscolare, come nel caso del polinicotinato Chrome.
Dov'è il cromo?
Il cromo si trova in una grande varietà di minerali e gemme, come rubini e smeraldi. Il minerale principale da cui viene estratto il cromo è il cromite (MCR2O4), Dove m può essere qualsiasi altro metallo con cui è associato l'ossido di cromo. Queste miniere abbondano in Sudafrica, in India, Turchia, Finlandia, Brasile e altri paesi.
Ogni fonte ha una o più varianti di cromite. In questo modo, per ogni m (Faith, Mg, Mn, Zn, ecc.) Sorge un minerale cromatico diverso.
Per estrarre il metallo è necessario. Questo viene fatto con carbonio o alluminio:
Fier2O4 + 4c => Fe + 2Cr + 4co
Allo stesso modo, viene trovata la cromita (pbcro4).
Di solito, in qualsiasi minerale dove l'ione CR3+ può sostituire al3+, Entrambi con radio ioniche leggermente simili, costituisce un'impurità che si traduce in un'altra fonte naturale di questo metallo sorprendente ma dannoso.
Riferimenti
- Tenebaum e. Cromo. Tratto da: chimica.Pomona.Edu
- Chimica librettexts. Chimica del cromo. Tratto da: Chem.Librettexts.org
- Cromo. Tratto da: chimica esplazionata.com

