Fondamenti, tipi, applicazioni di coulombimetria

- 3972
- 298
- Dott. Rodolfo Gatti
IL Coulombimetria È una tecnica di analisi elettrochimica che consiste nello svolgimento di un'elettrolisi esaustiva, in modo che l'analita possa essere quantificato; cioè, per determinare la concentrazione dell'analita nei problemi problemi attraverso la sua completa ossidazione o riduzione. È, a differenza della potenziometria, una tecnica dinamica, poiché la corrente può fluire liberamente attraverso le celle elettrochimiche.
Come suggerisce il nome, la carica elettrica Q, nelle unità di Coulomb, C, viene misurata e correlata con la concentrazione dell'analita ossidato o ridotto nelle periferie degli elettrodi. Pertanto, gli stati di ossidazione del cambiamento dell'analita, che si verificano nel processo un trasferimento e assorbimento degli elettroni che consente il calcolo stechiometrico della concentrazione desiderata.
 Assemblaggio rudimentale per un'elettrolisi in cui si formano diverse specie colorate a causa del pH e della complessazione dei silvicoltori presenti. Fonte: Steve Jurvetson di Menlo Park, USA, CC di 2.0, via Wikimedia Commons
Assemblaggio rudimentale per un'elettrolisi in cui si formano diverse specie colorate a causa del pH e della complessazione dei silvicoltori presenti. Fonte: Steve Jurvetson di Menlo Park, USA, CC di 2.0, via Wikimedia Commons Nella coulombimetria una batteria o potenziostat viene utilizzata per controllare la corrente o il potenziale applicato alle celle. Queste cellule, a differenza di quelle potenziometriche, sono costituite da un sistema a tre elettrodi e sono dotate di voltmetro e un amperometro.
La coulombimetria presenta il vantaggio di essere in grado di eseguire gradi senza preparare o standardizzare i modelli. Consente inoltre di quantificare quantità molto piccole e limitate di analiti, come cationi metallici, composti inorganici e composti organici. Ad esempio, esiste un coulometro progettato esclusivamente per misurare CO2 sciolto in campioni dall'oceano.
Questa tecnica offre un percorso analitico diverso rispetto a volumetrico e potenziometrico, così tante analisi, a seconda della natura elettrochimica dell'analita, possono sviluppare coulombimetricamente.
Fondamenti teorici della coulombimetria
Faraday Law
La coulombimetria si basa sulla legge di Faraday, che stabilisce una relazione tra la carica elettrica di una cella elettrochimica e la quantità di analita che si ossida o riduce. Conoscere questo carico Q, così come il carico di un elettrone (1.6 · 10-19 C), è possibile calcolare il numero di elettroni coinvolti in una reazione, NE-:
NE- = Q/E
D'altra parte, è noto che un mole di elettroni (6.02 · 1023) Porta una carica elettrica pari a 96485 C, una figura nota come costante di Faraday:
F = inA
= 96485.3365 c/mol
Essere conveniente per esprimere la quantità di elettroni a seconda delle talpe. Grazie a ciò, i coefficienti stechiometrici di una reazione elettrochimica possono essere usati, essere ossidazione o riduzione, tenendo conto di quante moli di elettroni vincono o perdono la specie.
Può servirti: fosfato di sodio: struttura, proprietà, sintesi, usiCalcoli di base
Ad esempio, considera la seguente equazione chimica:
OX + 2E- → rete
Misurando che quando l'intera specie di bue è stata ridotta a una rete, possiamo calcolare le moli di bue usando i fattori di conversione:
XQ · (mol E- /96485.3365 c) · (mol ox/ 2mol E-) = mol ox
Cioè, come conosciamo la carica elettrica per un mole di elettroni, avremo quanti elettroni corrispondono al carico XQ. Ma a sua volta, ogni 2 moli di questi elettroni vengono usati per ossidare 1 moli di bue.
Questo ragionamento provoca una formula diretta, anche se non è consigliabile memorizzarla, ma per poterlo dedurre come è stato fatto:
N = Q/(FNE-)
Dove NE- È il numero di moli di elettroni nell'equazione chimica.
A condizione che possa essere calcolato Q, indipendentemente dal tipo di coulombimetria, è possibile determinare le moli dell'analita di bue o rete; Finché, l'efficienza della corrente è al 100%. Quest'ultimo significa che tutto il carico che deve essere il prodotto di una sola trasformazione, senza che altre specie siano ridotte o ossidate.
Fondamenti sperimentali di coulombimetria
Cellule
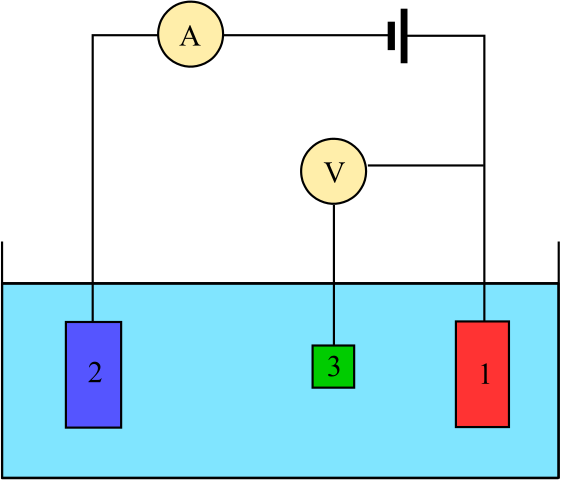 Diagramma per una cella elettrochimica composta da tre elettrodi: il riferimento (3), l'assistente (2) e il lavoro (1). Fonte: Adam Rędzikowski, CC BY-SA 3.0, via Wikimedia Commons
Diagramma per una cella elettrochimica composta da tre elettrodi: il riferimento (3), l'assistente (2) e il lavoro (1). Fonte: Adam Rędzikowski, CC BY-SA 3.0, via Wikimedia Commons Up abbiamo un diagramma per una cella con tre elettrodi, che è comunemente usato nelle analisi coulombimetriche. La reazione redox avviene tra gli elettrodi di lavoro (1) e ausiliari (2). Tra questi due sono collegati la batteria, per applicare i potenziali alla cella e l'amperometro (a), per misurare le correnti elettriche.
Tuttavia, è necessario un elettrodo di riferimento (3) per essere in grado di monitorare il potenziale dell'elettrodo di lavoro e quindi conoscere la variazione del potenziale per l'elettrodo ausiliario. In questo modo, il potenziale dell'intera cella può essere determinato ecellula, necessario stimare la fine delle reazioni redox in uno dei tipi di coulombimetria.
Si noti che tra l'elettrodo di lavoro e l'elettrodo di riferimento non scorre quasi la corrente a causa del voltmetro ad alta impedenza (V), grazie al quale esiste una lettura del potenziale per l'elettrodo di lavoro. Tra questi due elettrodi abbiamo un sistema simile a quello di un'analisi potenziometrica: è statico e non dinamico.
Può servirti: chimica nucleare: storia, campo di studio, aree, applicazioniPotenziale
La coulombimetria è, per così dire, un'elettrolisi effettuata per scopi analitici e quantitativi. Pertanto, si parla di applicare potenziali esterni, forniti da una batteria, per eseguire reazioni elettrochimiche non spontanee; cioè quelli che hanno potenziali negativi.
Considera, ad esempio, le seguenti reazioni accompagnate dai rispettivi standard potenziali:
Cu2+ + 2e- ⇌ cu (s) eºgriglia = +0.337 v
H2O ⇌ 1/2o2(g) + 2h+ + 2e- Eºgriglia = +1.230 v
Essere l'equazione della reazione globale pari a:
Cu2+ + H2Oppure ⇌ cu (s) + 1/2o2(g) + 2h+ Eºgriglia = -0.893 v
La batteria deve applicare un potenziale di 0.893 V in modo che l'elettrodo di rame e la formazione di ioni idrogeno. Questo potenziale è il Ecellula. Tuttavia, in pratica, deve essere applicato un potenziale maggiore di quanto calcolato, poiché ci sono potenziali che si oppongono all'evoluzione della reazione:
Ecellula = ECatodo - Eanodo - OP - IR - CP
Dove,
OP: sovrapotenziale (barriera cinetica)
IR: ohmic (potenziale intrinseco alle cellule)
CP: polarizzazione delle concentrazioni (prodotto delle diminuzioni in Cu2+)
Tipi di coulombimetria
Esistono tre tipi di coulombimetria: elettrogravimetrica amperostatica, potenziostatica ed elettrografica.
Amperostatico o galvanostatico
In questo tipo di coulombimetria, la corrente che scorre attraverso la cella è costante usando un amperostate. Pertanto, avere la corrente Yo Grazie alla lettura dell'amperometro e anche a conoscere il tempo T Una volta terminata l'elettrolisi, possiamo calcolare il carico associato alla trasformazione dell'analita:
Q = Articolo
Una conseguenza di mantenere l'attuale costante è che il potenziale cambiamento di elettrodi, positivamente o negativamente. Questa improvvisa variazione è indicativa che l'analita ha completamente reagito, che è quando l'elettrolisi si interrompe e viene misurata T. Questa è la base per i gradi coulometrici.
Se il potenziale continua o il caricamento, altre specie elettroattive indesiderate finiranno per reagire. Ecco perché i potenziali associati alle trasformazioni di interesse dovrebbero essere conosciuti perfettamente.
Potenziostatico
Un modo per prevenire altre specie. È qui in cui entra in possesso di potenzeorose coulombimetria, perché usa un potenziostete per impostare un certo potenziale per la cellula. A differenza della coulombimetria amperostatica, ora è la corrente che cambia il tempo.
Può servirti: toluene: struttura, proprietà, usi, ottenimentoA causa di questa configurazione tecnica, non possiamo calcolarlo direttamente con i valori di Yo E T; La corrente diminuisce nel tempo. Questo perché come reagisce l'analita, ci saranno sempre meno molecole o atomi che donano o accettano elettroni. Pertanto, che è uguale a un'area integrale sotto la curva grafica Yo vs T.
Elettrografico
La coulombimetria elettrografica, semplicemente nota come elettrogravimetria, è un'elettrolisi in cui non è necessario misurare i carichi o le correnti elettriche. Invece, le masse degli elettrodi vengono misurate prima e dopo l'elettrolisi.
Questa tecnica si applica solo quando le specie ridotte sono cationi metallici che sono elettrodepos sugli elettrodi, rendendoli più pesanti.
Applicazioni
Potenziostetico
Le analisi potenziostetiche consentono di ridurre o ossidare selettivamente una specie alla volta nel mezzo di una miscela. Ad esempio, vengono utilizzati per determinare la concentrazione dei seguenti ioni inorganici in quantità di tracce o in matrici complesse:
-Cu2+
-Asso3+
-CD2+
-Co2+
-Fede2+ e fede3+
-Pb2+
-X (f-, Cl-, Br- e io-)
-Nessuno dei due2+
-Pu3+
-Ag+
-Sn2+
-Zn2+
-O6+
Inoltre, queste analisi possono essere utilizzate per determinare la composizione di una lega. Una volta sciolta la lega acida, i potenziali cellulari vengono applicati in modo sfalsato e controllato, determinando così la quantità ridotta per ciascun catione metallo che la integra.
Gradi coulometrici
Nei gradi coulometrici, vengono utilizzati agenti di mediazione che si assicurano di neutralizzare o reagire completamente con l'analita rimanente. Lo scopo è prevenire potenziali variazioni, a una corrente costante, deriva nelle reazioni collaterali. Pertanto, è possibile che il supporto, ad esempio, acido ascorbico usando lo iodio come mediatore.
Alcuni cationi metallici, come AG+, EC3+, Fede3+, Mn2+, Voi3+, Cr2+, Possono anche essere determinati da questi gradi.
D'altra parte, le reazioni a base di acido possono ancora usare questa tecnica, poiché i grandi potenziali causano l'acqua ionici3O+ o oh-, che servono da agenti del titolo generati in situ; cioè, neutralizzeranno gli acidi o le basi presenti.
Il co2 dell'oceano, sono anche possibili le reazioni di precipitazione e la formazione di complessi con EDTA.
Riferimenti
- Giorno, r., & Underwood, a. (1986). Chimica analitica quantitativa (Quinto ed.). Pearson Prentice Hall.
- Skoog d.A., Ovest d.M. (1986). Analisi strumentale. (Secondo ed.). Inter -American., Messico.
- Dottore. Doug Stewart. (2020). Definizione di coulometria. Recuperato da: Chemicool.com
- Wikipedia. (2020). Coulometria. Recuperato da: in.Wikipedia.org
- Harvey David. (5 giugno 2019). Metodi coulometrici. Chimica librettexts. Recuperato da: Chem.Librettexts.org
- « Framework metodologico come scriverlo, struttura, esempi
- Origine della filosofia contemporanea, caratteristiche, correnti, autori »

