Coprecipitazione
- 2730
- 341
- Rosolino Santoro
Cos'è la coprecipitazione?
IL Coprecipitazione È la precipitazione di un solido che trascina normalmente sostanze solubili e che si verificano all'interno del solido o sulla sua superficie contemporaneamente a questo precipitato.
Visto in questo modo, puoi generare contaminazione di una sostanza insolubile che trasporta soluti disciolti del mezzo liquido. La parola "inquinamento" viene applicata a quei casi in cui i soluti solubili precipitati dal supporto insolubile sono indesiderabili, ma quando non lo sono, è un metodo analitico o sintetico alternativo.
D'altra parte, il supporto insolubile è la sostanza precipitosa. Questo può trasportare il soluto solubile all'interno (assorbimento) o sulla sua superficie (adsorbimento). Il modo in cui cambierà completamente le proprietà fisico -chimiche del solido risultante.
Sebbene il concetto di coprecipitazione possa sembrare un po 'confuso, è più comune di quanto si pensi, poiché si formano più che semplici solidi contaminati, soluzioni solide di strutture complesse e ricche. La terra da cui sono nutrite le piante, è un esempio di coprecipitazione.
Allo stesso modo, minerali, ceramiche, argille e impurità nel ghiaccio sono anche un prodotto di questo fenomeno. In caso contrario, i terreni perderebbero gran parte dei loro elementi essenziali, i minerali non sarebbero come sono noti e non ci sarebbe nemmeno un metodo importante per la sintesi di nuovi materiali.
Esempio di coprecipitazione
Per comprendere meglio l'idea della coprecipitazione, viene offerto il seguente esempio.
 Esempi di coprecipitazione. Fonte: Gabriel Bolívar
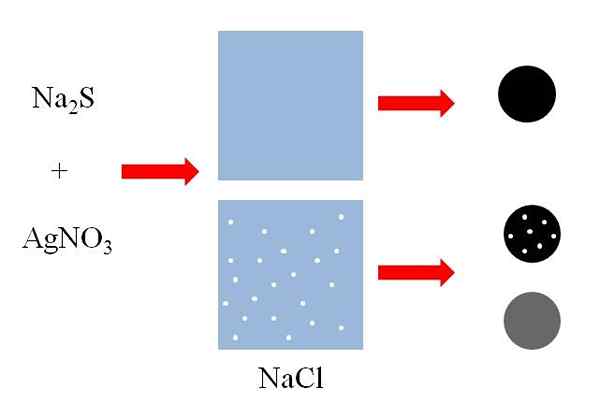
Esempi di coprecipitazione. Fonte: Gabriel Bolívar Superiore (immagine superiore) ci sono due contenitori con acqua, di cui si contiene NaCl disciolto. Il NaCl è un sale altamente solubile, ma le dimensioni dei punti bianchi sono esagerate per scopi esplicativi. Ogni punto bianco diventerà piccoli aggregati di NaCl in una soluzione al bordo della saturazione.
Può servirti: Fermio (FM)Aggiunta ad entrambi i contenitori una miscela di solfuro di sodio, NA2S e nitrato d'argento, agno3, Prepiterà un solido zolfo argento nero insolubile, AGS:
N / a2S + Agno3 => AGS + Nano3
Come si può vedere nel primo contenitore con acqua, un solido nero (sfera nera) precipita. Tuttavia, questo solido nel contenitore NaCl disciolto trasporta particelle di questo sale (sfera nera con punti bianchi). Il NaCl è solubile in acqua, ma quando l'AGS precipita, si addomina sulla superficie nera.
Si dice quindi che il NaCl coprecipita sulle AGS. Se il solido nero fosse analizzato, i microcristalli di NaCl potrebbero essere osservati in superficie.
Tuttavia, questi cristalli potrebbero anche essere all'interno dell'AGS, quindi il solido "girerebbe" grigio (bianco + nero = grigio).
Tipi Coprecipitazione
La sfera nera con punti bianchi e la sfera grigia mostrano che un soluto solubile può coprecipitare in modi diversi.
Nel primo, lo fa superficialmente, adsorbito sul supporto insolubile (AGS nell'esempio precedente), mentre nel secondo lo fa internamente, "cambiando" il colore nero del precipitato.
Si possono ottenere altri tipi di solidi? Cioè, una sfera con fasi nere e nere, cioè da AGS e NaCl (insieme a Nano3 che anche Coprecipita). È qui che sorge l'ingenuità della sintesi di nuovi solidi e materiali.
Tuttavia, tornando al punto iniziale, fondamentalmente il soluto di coprecitati solubile che genera diversi tipi di solidi. I tipi di coprecipitazione e i solidi che ne derivano saranno menzionati di seguito.
Può servirti: materiali che hanno poca resistenza al passaggio dell'elettricitàInclusione
Si parla di inclusione quando, nella rete cristallina, uno degli ioni può essere sostituito da parte della sostanza solubile coprecipitata.
Ad esempio, se NaCl era coprecipitato attraverso l'inclusione, ioni Na+ Avrebbero occupato il posto dell'AG+ In una sezione della disposizione cristallina.
Tuttavia, di tutti i tipi di coprecipitazione, questo è il meno probabile, poiché, perché si verifichi, le radio ioniche devono essere molto simili. Tornando alla sfera grigia dell'immagine, l'inclusione sarebbe rappresentata da uno di toni grigi più chiari.
Come accennato, l'inclusione è somministrata nei solidi cristallini e per ottenerli, dominio della chimica delle soluzioni e diversi fattori (t, pH, tempo di agitazione, relazioni molari, ecc.).
Occlusione
In occlusione, gli ioni sono intrappolati all'interno della rete cristallina ma senza sostituire alcun ione della disposizione. Ad esempio, all'interno degli AG è possibile formare cristalli di ocluido. Graficamente, potrebbe essere visualizzato come un cristallo bianco circondato da cristalli neri.
Questo tipo di coprecipitazione è uno dei più comuni e grazie ad esso c'è la sintesi di nuovi solidi cristallini. Le particelle obluide non possono essere eliminate con lavaggi semplici. Per fare ciò, sarebbe necessario ricristarsi l'intero set, cioè il supporto insolubile.
Sia l'inclusione che l'occlusione sono processi di assorbimento indicati nelle strutture cristalline.
Adsorbimento
Nell'adsorbimento, il solido coprecipitato si trova sulla superficie del supporto insolubile. La dimensione delle particelle di questo supporto definisce il tipo di solido ottenuto.
Può servirti: isóbarosSe sono piccoli, verrà ottenuto un solido coagulato, da cui è facile eliminare le impurità. Ma se sono molto piccoli, il solido assorbirà abbondanti quantità di acqua e sarà gelatinoso.
Tornando alla sfera nera con punti bianchi, i cristalli di NaCl coprecipitati sull'AGS possono essere lavati con acqua distillata. Quindi, fino a quando purificare gli AG, che possono quindi riscaldare per evaporare tutta l'acqua.
Applicazioni del Coprecipitazione
Alcune delle applicazioni di coprecipitazione sono le seguenti:
- Consente di quantificare sostanze solubili che non sono facilmente precipitate dal mezzo. Pertanto, attraverso un supporto insolubile, porta, ad esempio, isotopi radioattivi, come Francia, per lo studio e l'analisi successivi.
- Quando i ioni coprecipitanti nei solidi gelatinosi, il mezzo liquido viene purificato. L'occlusione è ancora più desiderata in questi casi, poiché l'impurità non sarà in grado di sfuggire.
- Coprecipitazione consente di incorporare sostanze nei solidi durante la loro formazione. Se il solido è un polimero, assorbirà soluti solubili che quindi coprecipiteranno all'interno, dandogli nuove proprietà. Se è la cellulosa, ad esempio, potrebbe essere realizzato cobalto (o altro metallo).
- Oltre a tutto quanto sopra, la coprecipitazione è uno dei metodi chiave per la sintesi di nanoparticelle su un supporto insolubile. Grazie a questo, i bionanomateriali e le nanoparticelle di magnetite sono stati sintetizzati, tra molti altri.
Riferimenti
- Precipitazione e co-precipitazione. Nptel si è ripreso.AC.In
- Cos'è la coprecipitazione. Recuperato da Wisegeek.com

