Concentrazione chimica

- 1004
- 126
- Ruth Cattaneo
 La concentrazione chimica è ciò che determina la proporzione di un soluto e un solvente in una soluzione chimica
La concentrazione chimica è ciò che determina la proporzione di un soluto e un solvente in una soluzione chimica Cos'è la concentrazione chimica?
IL Concentrazione chimica È una proprietà delle soluzioni che rappresentano la quantità di soluto per ogni unità di soluzione. In altre parole, è un numero che indica la proporzione in cui si trovano il soluto e il solvente.
Ricordiamo che una soluzione è una miscela omogenea formata da un solvente (generalmente liquido) e una o più sostanze sciolte nel solvente che chiamiamo soluti. Le soluzioni sono caratterizzate dal solvente, dal soluto e dalla concentrazione.
La concentrazione è una proprietà di proprietà molto utile, poiché ci consente di descriverli. Ad esempio, se sappiamo che la concentrazione di sale nell'acqua di mare è di 35 grammi per ogni litro, allora sappiamo che, nella nostra casa, dissoliamo 35 grammi di sale in un litro di soluzione, otterremo una soluzione uguale di salata.
Caratteristiche della concentrazione chimica
È una proprietà intensiva
Questa è la principale caratteristica della concentrazione. Intensivo significa che non dipende dalla quantità di soluzione che abbiamo. Ad esempio, ciò significa che la concentrazione è la stessa in una goccia di acqua di mare che in 100 litri della stessa.
Può variare con la temperatura
In generale, i liquidi si espandono o aumentano il loro volume durante il riscaldamento. Questo è vero anche per le soluzioni. Per questo motivo, le concentrazioni espresse a seconda del volume possono cambiare leggermente quando si riscaldano o si raffreddano la soluzione.
Può coprire gamme di gamma molto ampia
Indipendentemente dalle unità in cui viene espressa una concentrazione chimica, può avere da valori relativamente grandi, a valori estremamente piccoli.
Ad esempio, la concentrazione di una soluzione espressa in percentuale può avere valori dallo 0% al 100%, coprendo così molti ordini di grandezza. Potremmo preparare una soluzione al 90%, poiché potremmo anche prepararci una per 10-12%, che è quasi 14 ordini di grandezza minore.
A cosa serve la concentrazione chimica?
Conoscere la concentrazione di una soluzione ci consente di descriverla. Ci sono molte proprietà di soluzioni che dipendono dalla loro concentrazione. Ad esempio, il punto di fusione e di ebollizione dipende dalla concentrazione, quindi sapendo che ci consente di calcolare queste due proprietà.
Può servirti: stato vitreousD'altra parte, la concentrazione ci consente di confrontare facilmente una soluzione con un'altra. Se abbiamo due soluzioni idriche con lo zucchero, conoscere le loro concentrazioni ci permetterà di sapere quale dei due è più dolce.
Inoltre, tutte le reazioni chimiche che rendono possibile la vita dipendono fortemente dalla concentrazione di soluti infiniti nelle cellule e dall'ambiente circostante degli esseri viventi.
Ad esempio, la concentrazione di ossigeno nell'aria determina se una persona soffocerà o meno; Il pH di una soluzione (che è un modo per misurare la concentrazione di ioni H+) Determinare se un batterio vivrà e si riprodurrà o se, al contrario, morirà; e la concentrazione di un veleno determinerà se sarà letale o no.
Tipi di unità di concentrazione
La concentrazione di una soluzione è una, quindi non è corretto parlare di tipi di concentrazione. Tuttavia, la stessa concentrazione può essere espressa in diversi tipi di unità di concentrazione. Questi sono:
- Unità di concentrazione fisica
- Unità di concentrazione chimica
Unità di concentrazione fisica
Questi sono caratterizzati esprimendo le quantità del soluto e il solvente in unità di massa o di volume. Sono chiamati unità fisiche, poiché sono associati a masse e volumi invece di moli e equivalenti.
Quando confrontiamo due soluzioni che hanno la stessa concentrazione fisica, non possiamo garantire che abbiano uguali quantità di atomi e molecole. Questo è ciò che li distingue dalle unità di concentrazione chimica.
Le unità fisiche più comuni di concentrazione sono:
- Titolo semplice (TS)
- %peso/peso (%p/p) o massa/massa (%m/m)
- %peso/volume (%p/v) o massa/volume (%m/v)
- % volume/volume (% v/v)
- Parti per milione di peso/peso (ppmp/p) o massa/massa (ppmmm)
- Parti per milione di peso/volume (ppmp/v) o massa/volume (ppmm/v)
- Parti per milione di volume/volume (PPMV/v)
Unità di concentrazione chimica
Nel caso delle unità chimiche, la quantità di soluto e, in alcuni casi, quella del solvente o della soluzione, sono espresse in termini di numero di particelle o moli o equivalenti presenti nella soluzione.
Sono chiamate unità chimiche, poiché due soluzioni che hanno la stessa concentrazione chimica hanno quantità equivalenti di atomi, molecole o ioni soluto per unità di soluzione, a seconda dei casi.
Può servirti: regole di solubilità: aspetti e regole generaliLe unità chimiche più comuni sono:
- Molarità (M)
- Molalità (M)
- Frazione molare (x)
- Normalità (N)
Formula di unità di concentrazione fisica
Titolo semplice (TS)
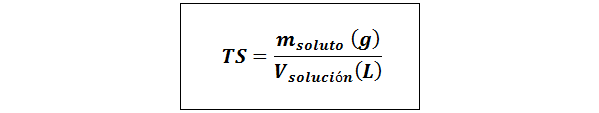
Dove msoluto rappresenta la massa del soluto in grammi e vsoluzione È il volume della soluzione in litri.
%peso/peso (%p/p) o massa/massa (%m/m)
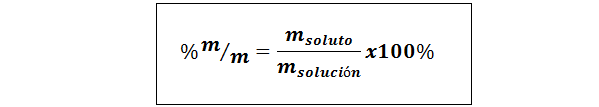
Dove msoluto e msoluzione rappresentare rispettivamente la massa del soluto e la soluzione. È possibile utilizzare qualsiasi unità di massa (G, Mg, Kg, ecc.), fintanto che entrambe le masse sono espresse nella stessa unità.
%peso/volume (%p/v) o massa/volume (%m/v)
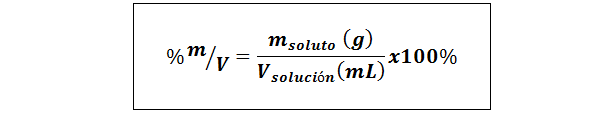
Dove msoluto È la massa della soluzione in grammi e vsoluzione È il volume della soluzione, in questo caso in millilitri.
% volume/volume (% v/v)

Dove vsoluto e vsoluzione rappresentare rispettivamente il volume del soluto e la soluzione. In questo caso, qualsiasi unità può essere utilizzata per esprimere questi volumi, purché sia lo stesso per entrambi.
Parti per milione di peso/peso (ppmp/p) o massa/massa (ppmmm)
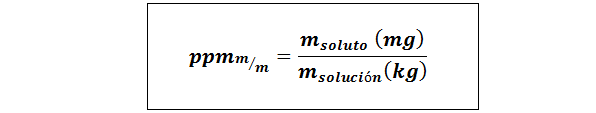
Dove msoluto e msoluzione Rappresentano la massa del soluto e la soluzione rispettivamente in milligrammi e chilogrammi.
Parti per milione di peso/volume (ppmp/v) o massa/volume (ppmm/v)
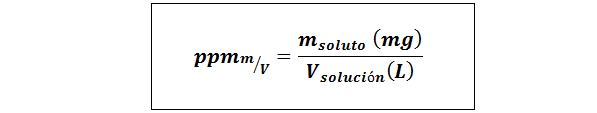
Dove msoluto È la massa della soluzione nei milligrammi e vsoluzione È il volume della soluzione, in questo caso in litri.
Parti per milione di volume/volume (PPMV/v)
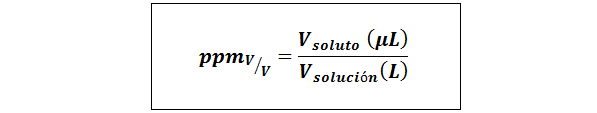
Dove vsoluto e vsoluzione Sono il volume del soluto e la soluzione in microlitri e litri, rispettivamente.
Formule delle unità di concentrazione chimica
Nel caso delle unità di concentrazione chimica, la quantità dei componenti della soluzione, in particolare del soluto, è espressa in numero di moli o in numero di equivalenti. Queste quantità hanno il numero reale di particelle (atomi, molecole o ioni, a seconda dei casi).
Queste quantità non possono essere conosciute semplicemente pesando o misurando il volume delle sostanze, ma è necessario conoscere la composizione o la formula chimica dei composti al fine di determinare la concentrazione. Questo è il motivo principale per cui sono chiamati concentrazioni chimiche.
Successivamente, le diverse formule sono presentate per calcolare le quattro concentrazioni chimiche più comunemente usate:
Molarità (M)
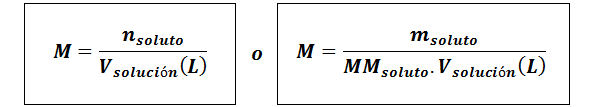
Dovesoluto Sono le moli di soluto, msoluto rappresenta la massa del soluto in grammi, mmsoluto è la sua massa molare e Vsoluzione È il volume della soluzione in litri.
Molalità (M)
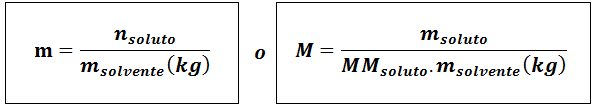
Dovesoluto Sono le moli di soluto, msoluto rappresenta la massa del soluto in grammi, mmsoluto È la sua massa molare e msolvente È la massa del solvente in chilogrammi.
Può servirti: solvatazioneFrazione molare (x)
La frazione molare può essere calcolata sia per il soluto che per il solvente. La frazione molare del soluto è:
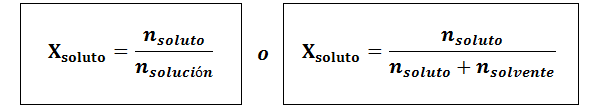
Il solvente è:
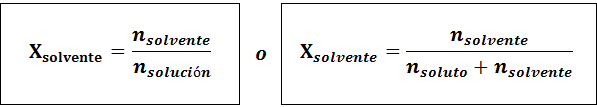
La relazione tra le due frazioni molari è:
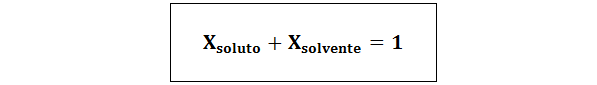
In tutti i casi nsoluto, Nsoluzione e nsolvente sono le moli di soluto, soluzione e solvente rispettivamente.
Normalità (N)
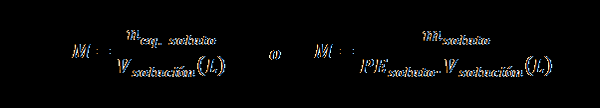
Qui nEq. soluto rappresenta il numero di equivalenti del soluto, msoluto rappresenta la massa del soluto, PEsoluto È il peso equivalente del soluto e vsoluzione È il volume della soluzione in litri.
Esempi di concentrazione chimica
- La concentrazione di sale nell'acqua marina è di 35 g/L, che corrisponde a una molarità di 0,60 mol/L.
- La concentrazione media di zucchero nel sangue è compresa tra 82 mg/dL e 110 mg/dl. Queste concentrazioni sono equivalenti a un titolo semplice a 0,82 g/L e 1,10 g/L e in molarità a 4,4.10-3 mol/L e 6.1.10-3 Mol/L, rispettivamente.
- L'aria può essere considerata una soluzione gassosa formata principalmente da azoto e ossigeno, il solvente è azoto, poiché è in proporzione maggiore. Questa soluzione di gas contiene una frazione di ossigeno e azoto di 0,22 di circa 0,78.
- L'acciaio è una lega tra ferro e carbonio. Sebbene non siano soluzioni strettamente, si tratta di miscele solide omogenee che di solito contengono una concentrazione di carbonio nell'ordine dello 0,03% e 1,075% in massa.
- Nonostante i suoi effetti devastanti per l'ambiente e per la salute degli esseri umani, le concentrazioni di molti inquinanti sono generalmente notevolmente basse. Un esempio è la massima concentrazione di metallo velenoso arsenico in acqua. L'Organizzazione mondiale della sanità (OMS) ha stabilito che l'acqua potabile non dovrebbe contenere una concentrazione di arsenico superiore a 10ppb m/v (parti per miliardi o nanogrammi per litro). Questa concentrazione è equivalente a 0.010 ppm m/v.
Riferimenti
- BBC (s. F.). Concentrazione di soluzioni - Calcoli in chimica - AQA - GCSE Chemistry (Single Science) Review - AQA. BBC preso.co.UK.
- Ecco cosa significa concentrazione in chimica (2020). Trovato da Thoughtco.com.
- LibreTexts (2022). 4.5: concentrazione di soluzioni. Tratto da Chem.Librettexts.org.
- Mandal, a., MD. (2021). Valori normali di zucchero nel sangue. Tratto da News-Medical.netto.
- Sostanze chimiche.Net (s. F.). Concentrazioni chimiche. Preso dalla sostanza chimica.netto.

