Storia della fotocamera Neubauer, caratteristiche, usi

- 1640
- 299
- Rufo Longo
IL Telecamera Neubauer, Heatimeter o echocitometro, è uno strumento di laboratorio che consiste in una speciale targa di vetro. Questa camera serve a eseguire alcuni tipi di cellule come globuli rossi, globuli bianchi e piastrine, sebbene possa essere utilizzata per contare spore, spermatozoi, parassiti, ecc.
Presenta caratteristiche molto peculiari, poiché è costituito da 3 zone, un centrale per il conteggio e due zone di supporto. Ogni fotocamera ha due aree di conteggio o reticoli, una nella parte superiore e una in basso.
 Telecamera Neubauer. Fonte: Santibadia [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)]. Immagine modificata.
Telecamera Neubauer. Fonte: Santibadia [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)]. Immagine modificata. Queste hanno più divisioni in forma di griglia. Le aree di conteggio sono le scatole medie che si trovano nei 4 angoli di entrambi i reticoli, oltre alla piazza centrale.
L'assemblaggio della fotocamera deve essere eseguito con molta attenzione, poiché qualsiasi dettaglio influenza il conteggio delle celle. Ci sono molti errori che possono essere commessi, ma se si verifica uno di essi, la fotocamera deve essere smonta. Tra gli errori principali, si può menzionare quanto segue:
Rebosar la telecamera o fare un riempimento insufficiente, lascia asciugare la telecamera, prova a rimuovere il fluido in eccesso con garza, inclina la fotocamera trasportandola, riempiendo una fotocamera sporca o bagnata, non mescolando la diluizione o il pozzo del campione, tra gli altri. Tutti questi errori comporteranno un valore irreale.
[TOC]
Storia
La fotocamera di Neubauer è uno strumento di precisione e nel processo di produzione passa attraverso un rigoroso controllo di qualità. È stato creato per particelle o forme precise da MM3, come cellule in vari liquidi. La sua grafica delicata è scolpita con diamante.
Caratteristiche della camera di Neubauer
La fotocamera completa ha le dimensioni di una diapositiva normale in modo che possa essere posizionata sulla piastra del microscopio.
La fotocamera è composta da tre superfici rettangolari centrali (A, B, C). Nella zona "B" la zona R o Count si trova, chiamata anche reticolo. Uno su ciascun lato della fotocamera, separato dalla zona "D".
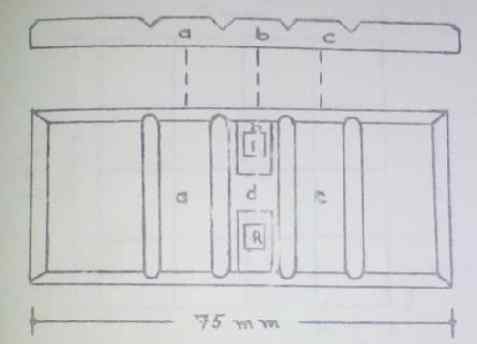 Schema grafico della fotocamera Neubauer. Fonte: Guida pratica ematologica. Scuola di bioanalisi dell'Università di Carabobo, Venezuela.
Schema grafico della fotocamera Neubauer. Fonte: Guida pratica ematologica. Scuola di bioanalisi dell'Università di Carabobo, Venezuela. Ogni reticolo è un'area lucida che contiene l'area di contributo incisa. È costituito da un quadrato con un'area di 9 mm2 Ed è internamente diviso in 9 immagini con 1 mm2 superficie. I quattro angoli sono divisi in 16 griglie più piccole (0.0625 mm2 Di superficie).
Queste griglie sono formate da una serie di linee millimetriche che si intersecano tra loro, che costituiscono griglie perfettamente grafiche e delimitate alle misure specificate. Queste linee sono state registrate con la punta del diamante.
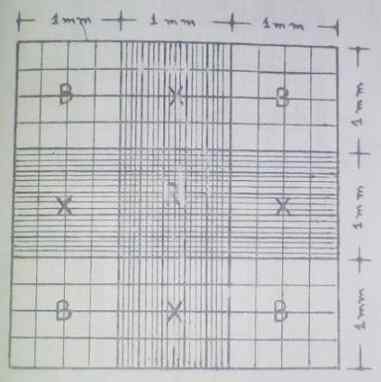 Reticolo Neubauer migliorato. Fonte: Guida pratica ematologica della scuola di bioanalisi dell'Università di Carabobo, Venezuela.
Reticolo Neubauer migliorato. Fonte: Guida pratica ematologica della scuola di bioanalisi dell'Università di Carabobo, Venezuela. I quattro lati corrispondono all'area di conteggio. In questi lati o angoli è dove viene eseguito il racconto della maggior parte delle cellule (globuli rossi e leucociti), mentre le piastrine vengono contate nell'area centrale.
Può servirti: Malachite Green: caratteristiche, preparazione, applicazioni, tossicitàLa zona centrale ha più divisioni, è costituita da una piazza da 1 mm2 diviso in 25 dipinti che hanno un'area di 0,04 mm2 ogni. Questi a loro volta sono divisi in 16 griglie con un'area di 0,0025 mm2.
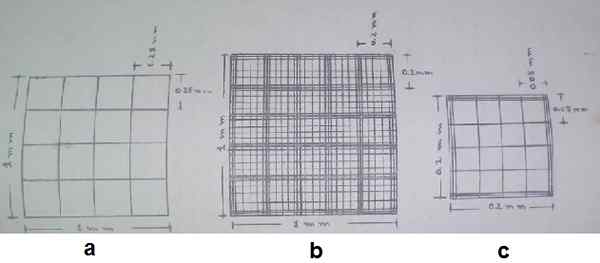 Descrizione del migliorato reticolo Neubauer. a) quadrato degli angoli, b) quadrato centrale, c) piazza media della piazza centrale. Fonte: Guida pratica ematologica della scuola di bioanalisi dell'Università di Carabobo, Venezuela.
Descrizione del migliorato reticolo Neubauer. a) quadrato degli angoli, b) quadrato centrale, c) piazza media della piazza centrale. Fonte: Guida pratica ematologica della scuola di bioanalisi dell'Università di Carabobo, Venezuela. L'area "A" e "C" funge da supporto per posizionare una speciale copertura di oggetti che si chiama lamella ematimetrica o coperture di ematimetro.
L'altezza tra la lamella e la superficie di conteggio è 0,1 mm. Le misure di superficie delle caselle di conteggio, nonché l'altezza della fotocamera e la diluizione del campione, sono dati necessari per eseguire i calcoli finali.
Applicazioni
È usato per il conteggio delle cellule. Soprattutto è molto utile nell'area di ematologia, poiché consente di realizzare le serie 3 delle cellule del sangue; cioè, globuli rossi, globuli bianchi e piastrine.
Tuttavia, può essere utilizzato in altre aree, ad esempio per contare sperma, spore, batteri o altri elementi importanti a seconda del tipo di campione.
Come viene usato?
preparazione del campione
Per eseguire il conteggio delle celle, di solito inizia da una diluizione precedente. Esempio: per contare i globuli bianchi, una diluizione 1:20 viene preparata con Turk Liquid. La diluizione è ben miscelata prima di caricare la pipetta e impostare la fotocamera Neubauer.
Ci sono occasioni in cui una diluizione 1:20 non è sufficiente per contare. Ad esempio, nei pazienti affetti da alcuni tipi di leucemie croniche. In questi casi, diluizioni più elevate dovrebbero essere fatte come 1: 100.
Se al contrario il conto è molto basso, come nelle leucopenie gravi, è possibile fare diluizioni più piccole per concentrare il campione. Esempio: puoi fare una diluizione 1:10.
Le modifiche che vengono apportate influenzano i calcoli.
Assemblaggio della camera di Neubauer
La camera di Neubauer è assemblata posizionando la lamella ematimetrica nella zona centrale. Entrambi devono essere molto puliti e asciutti. Per posizionare la lamella, viene presa dai bordi e lascia cadere delicatamente sulla telecamera.
Questo è riempito posizionando la punta di una pipetta automatica o di Thoma Pipette con un angolo di 35 ° sul bordo dell'area del carico. Il liquido viene dimesso delicatamente e la zona di caricamento viene riempita per capillarità. Questo viene fatto su entrambi i lati per caricare i due reticoli.
Nessun reticolo non deve essere sovraccarico e il liquido non deve essere negato. Il carico deve essere esatto. È importante che il ripieno sia fatto omogeneo, cioè non dovrebbero esserci bolle.
Una volta che la fotocamera è impostata a riposo per 2 minuti per far precipitare le celle in background e la sua visualizzazione e il conteggio è più facile.
Dopo che il tempo di riposo è stato montato alla luce del microscopio ottico per l'osservazione. Prima si concentra con un obiettivo 10x e, se necessario, viene passato a 40x.
Può servirti: gap anionPer migliorare la visualizzazione, la luce del microscopio è ridotta. Per fare questo, il condensatore viene abbassato e il diaframma si chiude un po '.
Account
Per il racconto dei globuli bianchi o dei leucociti, l'intera superficie dei quattro quadrati medi degli angoli e il quadrato centrale di ciascun reticolo deve essere contata.
Il conteggio inizia nel quadrato dell'angolo in alto a sinistra. Inizia dal primo quadrato della prima fila, cioè da sinistra a destra per raggiungere l'estremità opposta.
Lì viene abbassato e l'aspetto viene restituito da destra a sinistra fino a raggiungere l'altra estremità e quindi sulle celle all'interno di ciascuna griglia sotto forma di zigzag. Vengono contate le 16 griglie di ogni medio quadrato.
Per evitare di contare una cella due volte ci sono regole sulle celle che si trovano sulle linee confinanti di ogni griglia. Vengono contate le celle che si trovano nelle linee sinistro e superiori e quelle che si trovano a destra e le linee inferiori vengono ignorate.
Dovrebbe essere disponibile un contatore di celle manuali in modo che l'operatore opprime la chiave del dispositivo quante volte l'osservazione delle celle. Con l'uso del contabile, l'operatore può contare senza la necessità di cercare dal campo microscopico. Alla fine del conto osserverai il numero totale di celle contate.
Calcoli
Per i calcoli puoi procedere in diversi modi. È possibile contare un singolo reticolo o entrambi possono essere contati e una media di entrambi. In queste due situazioni le cellule contate devono essere moltiplicate per un fattore, che in questo caso sarebbe 40. E quindi si ottiene il conteggio totale per mm3.
Ma se i due reticoli vengono contati e non c'è media, deve essere moltiplicato per un fattore diverso, in questo caso per 20.
-Fattore di moltiplicazione
Successivamente, viene calcolato il fattore di moltiplicazione.
Per i calcoli vengono presi in considerazione diversi dati, incluso il titolo di diluizione, l'altezza della camera e la superficie raccontate.
Diluizione
La diluizione utilizzata in modo standard è 1:20 per il conteggio dei leucociti.
Altezza della camera
L'altezza tra la fotocamera e la lamina ematimetrica è di 0,1 mm.
Superficie contata
Se vengono contati 5 quadrati di 1 mm2 superficie, significa che il conto totale del conteggio è di 5 mm2. Questi dati devono essere moltiplicati per l'altezza della fotocamera per ottenere il volume totale raccontato. Cioè 5 mm2 x 0,1 mm = 0,5 mm3.
Formule e calcoli
Con i dati che si dice, si dice:
Se a 0,5 mm3 -ci sono ° di cellule contate
In 1 mm3 --ci sarà - x numero di celle
X cella n ° = (n ° di cellule Caled x 1) /0,5 mM3
Ma la diluizione deve anche essere presa in considerazione. Pertanto, la formula è la seguente:
(N ° di cellule conteggiate x 1) x 20/0,5 mm3
Infine, per riassumere puoi moltiplicare il numero di celle contate per 40. Pertanto si ottiene il valore dei leucociti per mm3.
Può servirti: osmosi: processo, tipi, differenze con diffusione ed esempiNel caso in cui i due reticoli vengano contati, i dati vengono modificati che in questo caso sarebbero 10 quadrati, cioè 10 mm2. E un volume totale raccontato di 1 mm3. La formula rimarrebbe:
(N ° di cellule contate x 1) x 20/1 mm3
Pertanto, in questo caso il fattore di moltiplicazione sarebbe 20.
Errori
-Se durante il caricamento della fotocamera viene superata o superata con fluido, l'altezza della fotocamera varierà. Ciò si traduce nel conteggio del vero. Se si tenta di rimuovere l'eccesso con garza o cotone, questo rappresenta un errore di carafal. Questa azione farà concentrare le cellule, aumentando il conteggio.
-Se viene accusato male, il conteggio sarà sotto il reale.
-Nel caso in cui la fotocamera sia montata e rilasciata, non è più possibile stabilire il conteggio perché trasmetterà risultati errati.
-Se prima di caricare la telecamera, la diluizione del campione non è ben miscelata, esiste un rischio di lettura, poiché le celle non saranno distribuite omogeneo. Pertanto, ci sarà meno o maggiore concentrazione di cellule, a seconda che il campione sia preso dalla superficie del liquido o dal fondo del tubo.
-La presenza di bolle riduce la quantità di liquido che deve entrare nel reticolo, interferendo con la corretta visualizzazione e distribuzione delle cellule. Tutto ciò influisce significativamente sui risultati.
-Durante il conteggio, non sollevare il microscopio fino a quando ogni grande quadrato non viene completato per evitare di perdersi.
-Un motivo dell'errore è quello di inchinare la fotocamera dopo montato. Pertanto, è necessario caricare con cura la piastra per microscopi.
Raccomandazione
Se per qualche motivo si rileva un'anomalia nel deposito della fotocamera, si consiglia di disassemblare quella preparazione, pulire la fotocamera e rimontare da zero.
Fai molta attenzione quando pulisci la fotocamera per evitare il graffio dei reticoli. D'altra parte, tieni presente che il lamel ematimetrico è delicato e fragile. La manipolazione inadeguata può romperlo.
Prima di iniziare a contare, assicurarsi che le celle siano state ben distribuite. Una distribuzione ineguale delle cellule si verifica da una scarsa miscela del campione o di diluizione. Se ciò accade, l'assemblaggio deve essere ripetuto.
Un modo per sapere se le celle sono ben distribuite sta confrontando il resoconto di ogni grande quadrato, il numero di celle contate da ogni quadrato non dovrebbe essere esageratamente diverso tra l'uno e l'altro.
-Se i globuli bianchi contano oltre 50.000 mm3 È consigliabile ripetere l'account, facendo una maggiore diluizione.
-Se modifica la diluizione, il fattore di moltiplicazione deve calcolare di nuovo, poiché ciò influenza la formula.
Riferimenti
- Cardona-Maya W, Berdugo J, Cadavid A. Confronto della concentrazione di sperma mediante la fotocamera di Makler e la fotocamera di Neubauer. Urol esp 2008; 32 (4): 443-445. Disponibile su: scielo.
- Telecamera Neubauer. (2018, 27 marzo). Wikipedia, Enciclopedia gratuita. Data di consultazione: 04:10, 23 giugno 2019 da ES.Wikipedia.org
- Meneses A, Rojas L, Sifontes S. Applicazione di un metodo di conteggio alternativo nella camera di Neubauer per determinare la concentrazione di Vaginalis Trichomonas. Rev. Cub Med Trop 2001; 53 (3): 180-8. Disponibile su: ResearchGate.netto
- Gómez-Pérez Roald E. Analisi degli esperti. Rev. Venez. Endocrinolo. Metab. 2007; 5 (2): 19-20. Disponibile su: VE.Scielo
- Guida all'ematologia pratica della scuola di bioanalisi dell'Università di Carabobo. Venezuela.1998
- « Aspetti positivi o negativi presenti nella democratizzazione della conoscenza
- Aspetto più importante della piccola scienza, della grande scienza e della tecnica »

