Proprietà del cloruro di manganese, struttura, usi, rischi

- 5079
- 1136
- Enzo De Angelis
Lui cloruro di manganese È un sale inorganico la cui formula chimica è MCL2. È costituito da ioni Mn2+ e cl- in un rapporto 1: 2; Per ogni cation Mn2+ Ci sono due volte da cl anioni-.
Questo sale può formare diversi idrati: MNCL2· 2h2Oppure, (diidrato), MCL2· 4h2O (tetraidrato) e MCL2· 6h2O (esaidrato) la forma più comune di sale è tetraidrato.
 Cristalli di cloruro di manganese rosa. Fonte: Ondřej Mangl [dominio pubblico]
Cristalli di cloruro di manganese rosa. Fonte: Ondřej Mangl [dominio pubblico] Le proprietà fisiche del cloruro di manganese come la densità, la fusione e il punto di solubilità nell'acqua, sono influenzate dal loro grado di idratazione. Ad esempio, il punto di fusione della forma di Anhydra è molto maggiore di quello della forma di tetraidrate.
Il colore del cloruro di manganese è rosa pallido (immagine superiore). Il pallide è caratteristico dei sali di metalli di transizione. Il cloruro di manganese è un debole acido Lewis.
Il minerale noto come escacquita è la forma anidra naturale di cloruro di manganese (II); Come la Kemita.
Il cloruro di manganese (II) è usato come agente in lega; Catalizzatore nelle reazioni di clorazione, ecc.
[TOC]
Proprietà fisiche
Aspetto fisico
- Forma Anhydra: cristalli cubici rosa.
- Forma di tetraidrate: cristalli monoclinici rossastri leggermente delicati.
Masse molari
- Anhidro: 125.838 g/mol.
- Diidratato: 161.874 g/mol.
- Tetraidrate: 197,91 g/mol.
Punti di fusione
- Anhidro: 654 ºC.
- Diidratato: 135 ºC.
- Tetraidrato: 58 ºC.
Punto di ebollizione
Forma Anhidra: 1.190 ºC.
Densità
- Anidro: 2.977 g/cm3.
- Diidratato: 2,27 g/cm3.
- Tetraidrate: 2,01 g/cm3.
Solubilità dell'acqua
Forma Anhydra: 63,4 g/100 ml a 0 ºC; 73,9 g/100 ml a 20 ºC; 88,5 g/100 ml a 40 ° C; e 123,8 g/100 ml a 100 ° C.
Solubilità nei solventi organici
Solubile in piridina ed etanolo, insolubile in etere.
Decomposizione
A meno che non vengano prese precauzioni dovute, la disidratazione delle forme idratate a forma anidra può causare disidratazione idrolitica, con la produzione di cloruro di idrogeno e ossicloruro di manganese.
ph
Una soluzione 0,2 m di cloruro di manganese tetraidrato in soluzione acquosa ha un pH di 5,5.
Può servirti: cromatogrammaStabilità
È stabile, ma sensibile all'umidità e incompatibile con acidi forti, metalli reattivi e perossido di idrogeno.
Struttura del cloruro di manganese
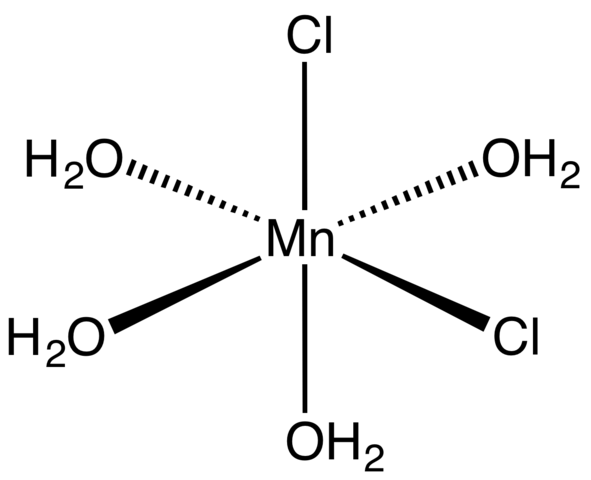 Complesso di coordinamento per tetraidrate MNCL2. Fonte: Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)]
Complesso di coordinamento per tetraidrate MNCL2. Fonte: Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] A partire dal sale tetraidrato, dai cristalli rosa e sorprendenti, deve essere composto da complessi di coordinazione (immagine superiore). In essi, il centro metallico MN2+ è circondato da un ottaedro definito da quattro molecole2O e due anioni cl-.
Si noti che i ligandi CL- Sono in posizioni cis; Tutti sono equivalenti nella base rettangolare dell'octaedro e non importa se il CL viene "spostato"- in una qualsiasi delle altre tre posizioni. Un altro possibile isomero per questa molecola coordinata è in cui entrambi- Sono in posizioni trans; cioè, a estremità diverse (uno sopra e l'altro sotto).
Le quattro molecole d'acqua con i loro ponti idrogeno consentono a due o più ottaedri di unirsi alle forze dipolo-dipolo. Questi ponti sono altamente direzionali e aggiungono le interazioni elettrostatiche tra MN2+ e cl-, Stabiliscono una struttura ordinata caratteristica di un cristallo.
Il colore rosa dell'MNCL2· 4h2O è dovuto alle transizioni elettroniche dell'MN2+ e la sua configurazione D5. Allo stesso modo, i disturbi causati dalle vicinanze delle molecole d'acqua e i cloruri modificano la quantità necessaria di energia che tali elettroni devono assorbire5 Per viaggiare a livelli di energia più alti.
Diidrata
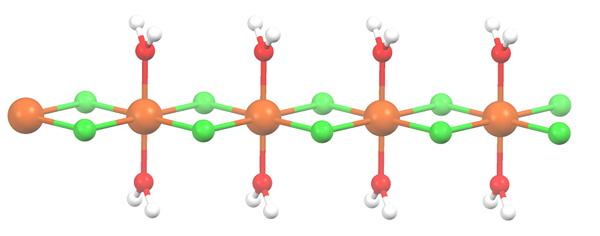 Struttura polimerica per MNCL2 · 2H2O. Fonte: Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)]
Struttura polimerica per MNCL2 · 2H2O. Fonte: Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] Il sale si è disidratato e la sua formula ora diventa MCL2· 2h2O. Cosa succede all'ottaedro anteriore? Niente, tranne che le due molecole H2O che hanno abbandonato sono sostituiti da due CL-.
All'inizio puoi dare l'impressione sbagliata che ci siano quattro CL- Per ogni Mn2+; Tuttavia, metà dell'ottaedro (assialmente) è in realtà l'unità ripetitiva del vetro.
Quindi, è vero che esiste un MN2+ coordinato a due CL- e due molecole d'acqua in posizioni trans. Ma affinché questa unità interagisca con un'altra, ha bisogno di due ponti Cl, il che a sua volta consente di completare l'ottaedro di coordinamento per il manganese.
Può servirti: elementi diatomiciOltre ai ponti CL, le molecole d'acqua collaborano anche con i loro ponti idrogeno in modo che questa catena MNCL2· 2h2O non disarmare.
Anidro
Infine, il cloruro di magnesio ha finito di perdere tutta l'acqua contenuta nei suoi cristalli; Hai il sale Anhydra ora, MCL2. Senza le molecole d'acqua, i cristalli perdono significativamente l'intensità delle loro colorazioni rosa. L'ottaedro, come per gli idrati, rimane invariato dalla stessa natura manganese.
Senza molecole d'acqua, il MN2+ Fine circondate da un ottaedro composto solo da CL-. Questo collegamento di coordinamento ha un carattere sia covalente che ionico; Per questo motivo di solito si riferisce alla struttura del MNCL2 Come un cristallo polimerico. In esso ci sono strati alternativi di Mn e Cl.
Nomenclatura
Il manganese ha molti possibili stati di ossidazione. Per questo motivo, la nomenclatura tradizionale per l'MNCL2 Non è chiarito.
D'altra parte, il cloruro di manganese corrisponde al suo nome più noto, a cui non mancherà di aggiungere il "(ii)" in modo che sia secondo lo stock di nomenclatura: cloruro di manganese (ii). E Asçi, è la nomenclatura sistematica: il dicloruro di manganese.
Applicazioni
Laboratorio
Il cloruro di manganese funge da catalizzatore per la clorazione dei composti organici.
Industria
Il cloruro di manganese è usato come materia prima per l'elaborazione di anti -artigianali per la benzina; materiale di saldatura per metalli non ferrosi; intermediario nell'elaborazione dei pigmenti; E bevanda olio di Linaza.
Viene utilizzato nell'industria tessile per la stampa e il tinto; Nella produzione di diversi sali di manganese, incluso il tricarbonile della metilciclopentadienilmanganese usata come colorante di mattoni; e nella produzione di batterie elettriche essiccate.
Il cloruro di manganese viene usato come agente in lega e viene aggiunto al magnesio fuso per produrre leghe di magnesio del manganese; come intermediario nella preparazione di agenti di essiccazione per la pittura e la vernice; e come componente dei disinfettanti.
Può servirti: idrossido di sodio (NaOH): struttura, proprietà, usi, sintesiViene anche usato nella purificazione del magnesio.
Fertilizzante e mangime per animali
Il cloruro di manganese è usato come fonte di manganese, elemento, che, sebbene non sia un elemento nutrizionale primario per piante come azoto, fosforo e potassio, è usato in numerose reazioni biochimiche di questi esseri viventi di questi esseri viventi.
Si aggiunge anche all'alimentazione degli animali da riproduzione per la fornitura di manganese, un oligoement essenziale per la crescita degli animali.
Il cloruro di manganese è una componente dietetica che fornisce manganese, un elemento che interviene in numerosi processi necessari per la vita, tra cui: sintesi di acidi grassi e ormoni sessuali; assimilazione della vitamina E; produzione di cartilagine; eccetera.
Rischi
Può produrre per contatto con arrossamento della pelle, irritazione e dermatite dell'esposizione prolungata. Il cloruro di manganese provoca arrossamento, dolore e lacrima.
Per inalazione la causa del sale, il mal di gola e la mancanza di respiro. D'altra parte, l'ingestione potrebbe verificarsi vomito, nausea e diarrea.
L'inalazione cronica eccessiva di questo sale può portare all'infiammazione polmonare e alla successiva malattia reattiva delle vie aeree.
La sua eccessiva ingestione può causare disturbi mentali, disidratazione, ipotensione, insufficienza epatica e renale, insufficienza e morte del sistema multiorganico.
La neurotossicità è la manifestazione iniziale dell'azione indesiderabile del manganese, essendo in grado di presentare mal di testa, vertigini, perdita di memoria, iperreflessia e tremore lieve.
La grave tossicità si manifesta con sintomi e segni simili a quelli osservati nella malattia di Parkinson.
Riferimenti
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Wikipedia. (2019). Cloruro di manganese (ii). Recuperato da: in.Wikipedia.org
- Nanomateriali primaverili del cielo. (2016). Polvere di cloruro di manganese. Recuperato da: ssnano.com
- Libro chimico. (2017). Cloruro manganese. Recuperato da: chimico.com
- Rete di dati tossicologici. (S.F.). Cloruro manganese. Txnet. Recuperato da: txnet.Nlm.NIH.Gov
- Gérard Cahiez. (2001). Cloruro di manganese (ii). doi.org/10.1002/047084289X.RM020
- Centro nazionale per le informazioni sulla biotecnologia. (2019). Dicloruro di manganese. Database PubChem. CID = 24480. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov
- WebConsultas Healthcare, s.A. (2019). Minerali: manganese. Recuperato da: consulenza web.com

