Enzima cinetico
- 1554
- 40
- Lino Lombardi
Cos'è la cinetica enzimatica?
IL Enzima cinetico È un campo di studio in cui la fisica e la biochimica si incontrano per studiare le reazioni chimiche catalizzate dagli enzimi. Gli enzimi sono catalizzatori biologici che aumentano la velocità di una reazione chimica diminuendo la loro energia di attivazione.
Gli enzimi catalizzano le reazioni chimiche di grande importanza per il mantenimento della vita. Hanno sia un pH che una temperatura ottimale per esercitare la loro azione catalitica sul substrato, quindi sono fattori essenziali nello studio delle loro attività.
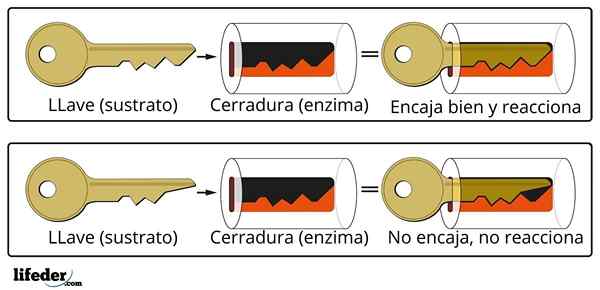
 Il sistema di chiusura della chiave è un'analogia approssimativa al sistema di enzima del substrato.
Il sistema di chiusura della chiave è un'analogia approssimativa al sistema di enzima del substrato. L'enzima interagisce con il substrato attraverso una regione specializzata della sua catena proteica, che è chiamata centro attivo, la cui struttura tridimensionale è accoppiata alla struttura del substrato. L'interazione tra il centro attivo e il substrato è generalmente debole e non covalente.
Il numero di centri enzimatici attivi è limitato, producendo la sua saturazione con molecole di substrato, che a sua volta impedisce la velocità della reazione che aumenta oltre un certo valore, nota come velocità massima.
La cinetica enzimatica non solo combina biochimica e fisico -chimica, ma anche chimica bioinorganica, supramolecolare, chimica computazionale e statistiche.
Tra i modelli che lo descrivono è quello di Michaelis -menc. Oggi è ancora uno dei modelli più utilizzati per descrivere la cinetica enzimatica.
Concetti di base nella cinetica enzimatica
Catalisi enzimatica
Gli enzimi sono proteine, con attività catalitiche, in grado di agire su una molecola chiamata substrato, catalizzando la sua trasformazione in un'altra sostanza nota come prodotto. Gli enzimi non vengono consumati durante la loro azione catalitica, rimanendo la loro massa costante.
Attività catalitica
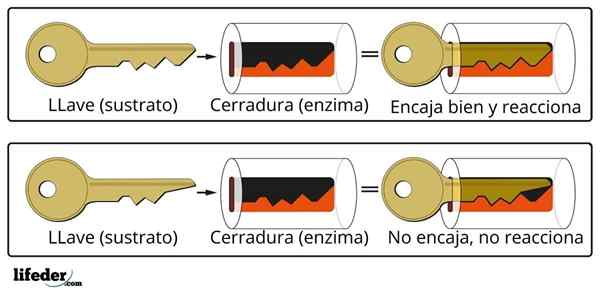
L'attività catalitica dell'enzima viene eseguita in una struttura tridimensionale specializzata nota come centro attivo. Questo è formato dalla piega della catena proteica enzimatica che determina l'interazione di un gruppo di aminoacidi che formano il centro attivo.
Centro attivo
Il centro attivo non è una struttura rigida, ma in grado di adattarsi geometricamente al substrato per interagire con esso. L'interazione è generalmente debole (forze di van der Waals), sebbene ci siano enzimi che formano un legame covalente con il substrato.
Può servirti: grasso butirico: ottenere, tipi, composizione, usi, beneficiDiminuzione dell'energia di attivazione
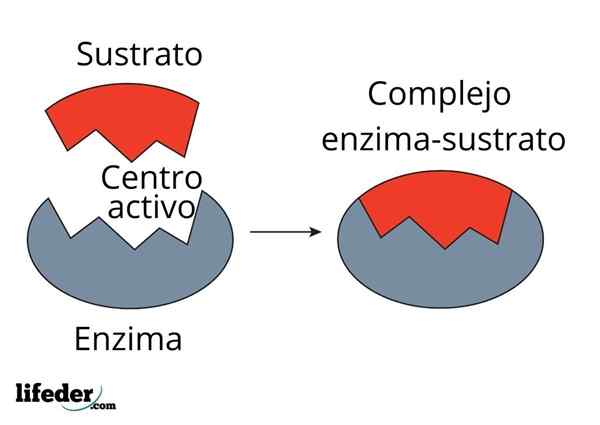
 L'enzima anidrasi carbonica diminuisce l'energia di attivazione per la conversione da CO2 a H2CO3. Fonte: fvasconcellos (talk • contributi), cc by-sa 3.0, via Wikimedia Commons
L'enzima anidrasi carbonica diminuisce l'energia di attivazione per la conversione da CO2 a H2CO3. Fonte: fvasconcellos (talk • contributi), cc by-sa 3.0, via Wikimedia Commons Gli enzimi catalizzano le reazioni che diminuiscono l'energia di attivazione e quindi riduce anche il consumo di energia libera (g) necessaria per il completamento del processo catalizzato. Gli enzimi non modificano il punto di equilibrio delle reazioni chimiche non catalizzate.
Nota come l'enzima anidrasi carbonica riduce l'energia di attivazione per la co -conversione2 a h2Co3. Sebbene la distanza tra il rosso e la linea bluastra non sembra molto, questo enzima aumenta la velocità nell'ordine di milioni di volte (106), rispetto alla reazione effettuata senza la loro partecipazione.
Stereoespecificità
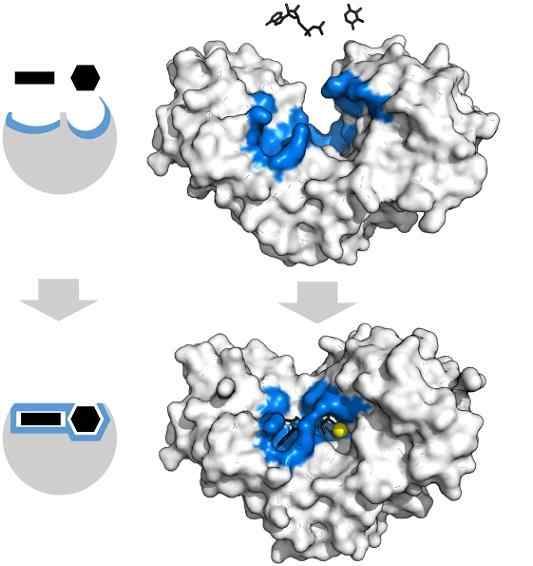 I substrati di adenosina trifosfato e xilosio hanno la forma specifica che coincide con la geometria del centro attivo dell'enzima esochinasi. Fonte: Thomas Shafee, CC di 4.0, via Wikimedia Commons
I substrati di adenosina trifosfato e xilosio hanno la forma specifica che coincide con la geometria del centro attivo dell'enzima esochinasi. Fonte: Thomas Shafee, CC di 4.0, via Wikimedia Commons Gli enzimi, in generale, sono altamente specifici per le reazioni che catalizzano, poiché le molecole del substrato devono interagire con il centro attivo che presenta una serie di requisiti per il loro accoppiamento con esso.
Pertanto, ad esempio, il centro attivo dell'exochinasi, che è dinamico a causa delle vibrazioni molecolari delle catene proteiche, offre gruppi in orientamenti spaziali esatti in modo che adenosina e molecole di adenosina xilosio.
Il minimo disturbo fisico o chimico e la regione blu -esochinasi non possono più ospitare i substrati.
Velocità massima
Gli enzimi hanno un numero limitato di centri attivi, quindi aumentando la concentrazione di substrato. Ciò determina che la velocità della reazione catalizzata non può aumentare oltre un certo valore, nota come velocità massima.
Sensibilità alla temperatura e pH
L'attività catalitica enzimatica dipende dalla temperatura e dal pH, con valori ottimali di questi parametri per il suo funzionamento. Allo stesso modo, poiché sono le molecole proteiche degli enzimi, sono suscettibili a una denaturazione chimica o termica.
Cofattori
Alcuni enzimi aumentano la loro attività catalitica a causa dell'influenza di alcuni fattori, che possono essere metalli o composti organici noti come coenzimi.
Allo stesso modo, gli enzimi possono essere inibiti in modo competitivo e non competitivo. Nel caso dell'esochinasi dall'alto, il MG2+ (sfera gialla) funge da cofattore.
Velocità di reazione enzimatica
La velocità di una reazione enzimatica dipende dalla concentrazione di substrato e concentrazione enzimatica. Quando la concentrazione di substrato è bassa, c'è una relazione quasi lineare tra velocità enzimatica e concentrazione di substrato.
Può servirti: nessun metallo: storia, proprietà, gruppi, usiPertanto, la velocità enzimatica aumenta della proporzione diretta alla concentrazione del substrato; Ma aumentando la concentrazione di substrato a un valore che satura dei siti attivi dell'enzima, la velocità massima viene raggiunta.
Una volta che si verifica la velocità enzimatica, diventa costante, cioè è indipendente dalla concentrazione del substrato e si dice che la velocità enzimatica sia zero. Inoltre, la velocità enzimatica catalitica è proporzionale alla concentrazione del complesso enzimatico-substrato [IS].
Come mostra l'espressione matematica:
V = k2[È]
La velocità massima è direttamente proporzionale alla concentrazione totale dell'enzima, come appare nella seguente formula:
VMax = KGattoET
KGatto È il numero di rotazione o sostituzione e rappresenta il numero di molecole di substrato che ciascun sito enzimatico si converte in un prodotto per unità di tempo. MentreT rappresenta il numero di siti enzimatici catalitici. SÌT Ha un valore elevato, è necessario un [s] più alto per saturare i siti o i centri attivi.
Equazione di Michaelis -mente
Modello
Il modello Mihaelis -mente si basa sull'azione degli enzimi che agiscono su un substrato semplice e non è applicabile agli enzimi alosterici; Cioè, quelli che hanno una regione regolatoria dell'attività catalitica del sito attivo.
Gli enzimi a bassa concentrazione di substrato hanno un'attività catalitica lineare con la concentrazione di substrato; Ma ad alte concentrazioni di substrato, l'attività catalitica è indipendente dalla concentrazione di substrato.
Nel 1913, Leonor Michelis e Maud Mind hanno proposto un modello per spiegare il comportamento enzimatico indicato, l'esistenza di un complesso intermedio enzimatico-sustrato [è] essendo importante nel modello [IS].
Equazione generale
La relazione di questo complesso con gli altri componenti del processo enzimatico, nonché con le costanti (k) che li mettono in relazione, sono indicati nel seguente schema:
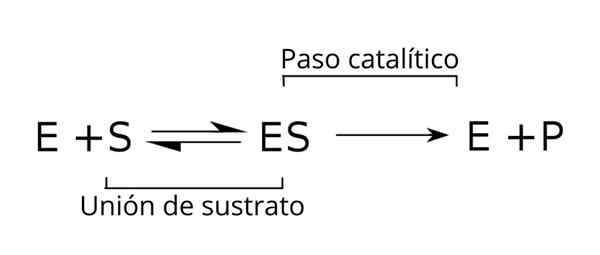 Equazione generale dei substrati, il complesso enzimatico-substrato e i prodotti della cinetica enzimatica. Fonte: Tim Vickers via Wikipedia.
Equazione generale dei substrati, il complesso enzimatico-substrato e i prodotti della cinetica enzimatica. Fonte: Tim Vickers via Wikipedia. L'enzima (E) è combinato con i substrati per formare il complesso enzimatico-substrato con una costante di velocità K1. Il complesso E-S può dissociarsi in E e S con una costante di velocità di reazione k-1.
Allo stesso modo, il complesso è può causare un prodotto (P) e la separazione dell'enzima, che può essere riciclato per soddisfare un altro ciclo di attività enzimatica. È possibile ottenere una situazione di equilibrio per lo stato [è] in cui la sua velocità di formazione è uguale alla sua velocità di decomposizione.
Può servirti: elementi chimici naturaliK1[Is] [s] = (k-1 + K2) [IS] (1)
Termini raggruppati e cancellamento [IS], hai:
[Is] = ([e] [s]) / (k-1 + K2 / K1) (2)
KM = (K-1 + K2) / K1
KM È una costante introdotta da Michaelis.
Termini dell'equazione di Michaelis -mente
Sostituire ora kM In (2) continuiamo:
[Is] = [e] [s] / kM (3)
La concentrazione di enzima non combinato è:
[E] = [ET] - [ES] (4)
Dove [e] è l'enzima libero e [eT] La concentrazione totale dell'enzima.
Combinando le equazioni 3 e 4, effettuando le sostituzioni dovute e anche tenendo conto di VMax, Viene raggiunta l'equazione di Michaelis-Muene, espressa nel modo seguente:
V = (vMax [S]) / ([s] + kM)
La velocità massima della reazione enzimatica si verifica quando la concentrazione di substrato è molto maggiore di kM E i siti catalitici degli enzimi sono saturi di substrato. Ciò si verifica quando la relazione [s]/[s] + kM Approcci a 1.
Quando [s] è uguale a kM, La parte dell'equazione [s] / [s] + kM è uguale a 1/2, indicando che kM È la concentrazione di substrato che produce una velocità di reazione enzimatica che è la metà della velocità massima.
Inoltre, kM È una misura dell'affinità di un enzima per il substrato: maggiore è il valore di KM, Minore sarà l'affinità dell'enzima per il substrato e viceversa. Pertanto, a un kM alta la velocità della reazione enzimatica sarà bassa.
Grafico di Lineweaver-Burk
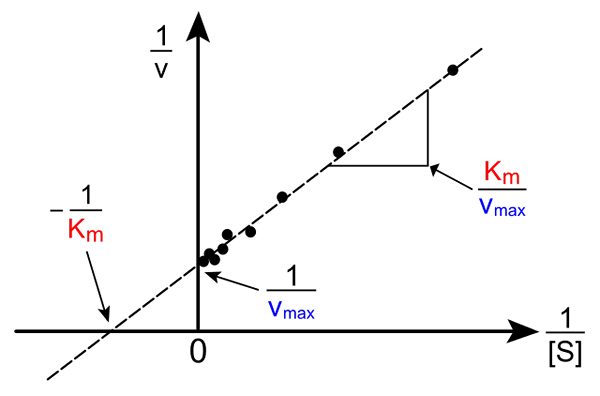 Lineweaver-Burk dritto. Fonte: Pro Bug Catcher tramite Wikipedia.
Lineweaver-Burk dritto. Fonte: Pro Bug Catcher tramite Wikipedia. La trasformazione dell'equazione di Michaelis-Muene per produrre la sua forma inversa ha la seguente forma:
1/v = (kM / VMax) (1 / [s]) + 1 / vMax
L'importanza di questa linea è che ha un incrocio con l'asse x in - 1/kM, e con l'asse y su y = 1/vMax (Immagine superiore). La linea ha una pendenza di KM/Vmax. Ciò consente informazioni su VMax e kM graficamente l'inverso delle velocità in base all'inverso delle concentrazioni di substrato.
Riferimenti
- Strayer, l. (1975). Biochimica. 2dà Edizione. Editoriale tornato.
- Iran. Levine. (2009). Principi di fisica. Sesta edizione. Mc Graw Hill.
- Wikipedia. (2020). Cinetica enzimatica. Recuperato da: in.Wikipedia.org
- Michael Blaber. (5 giugno 2019). Cinetica enzimatica. Biologia librettext. Recuperato da: biografia.Librettexts.org
- I redattori di Enyclopedia Britannica. (2020). Cinetica di Michaelis-Muen. Recuperato da: Britannica.com
- Berg JM, Tymoczko JL, Stryer L. Biochimica. 5a edizione. New York: W H Freeman; (2002). Sezione 8.4: Il modello Michaelis spiega le proprietà cinetiche di molti enzimi. Recuperato da: NCBI.Nlm.NIH.Gov

