Acido tartarico
- 913
- 83
- Zelida Gatti
Spieghiamo cosa è l'acido tartarico, le sue proprietà fisiche e chimiche, la sua struttura e le sue applicazioni
Cos'è l'acido tartarico?
Lui acido tartarico È un composto organico la cui formula molecolare è COOH (CHOH)2COOH. Ha due gruppi carbossilici; Cioè, puoi rilasciare due protoni (h+). In altre parole, è un acido diprotico. Può anche essere classificato come un acido aldarico (zucchero acido) e un derivato dell'acido succinico.
Il suo sale è noto da tempo immemorabile e costituisce uno dei prodotti secondari dell'elaborazione del vino. È cristallizzato come un sedimento bianco battezzato come "diamanti del vino", che si accumulano nel sughero o sul fondo delle botti e delle bottiglie. Questo sale è bitartrato di potassio (o acido di potassio tartrato).
I sali di acido tartarico hanno in comune la presenza di uno o due cationi (Na+, K+. NH4+, AC2+, eccetera.) Perché, rilasciando i suoi due protoni, rimane negativamente carico di un carico di -1 (come con i sali di biterrato) o -2.
A sua volta, questo composto è stato oggetto di studio e insegnamento delle teorie organiche legate all'attività ottica, più precisamente con la stereochimica.
Dov'è l'acido tartarico?
L'acido tartarico è un componente di molte piante e cibo, come albicocche, avocado, mele, tamarindos, semi di girasole e uva.
Nel processo di invecchiamento dei vini questo acido - a temperature fredde - è combinato con potassio per cristallizzare come tartrato. Nei vini rossi, la concentrazione di questi tartrat è inferiore, mentre nei vini bianchi sono più abbondanti.
I tartrati sono sali di cristalli bianchi, ma quando occludono le impurità dell'ambiente alcolico, acquisiscono toni rossastri o viola.
Può servirti: reazione di spostamentoStruttura dell'acido tartarico
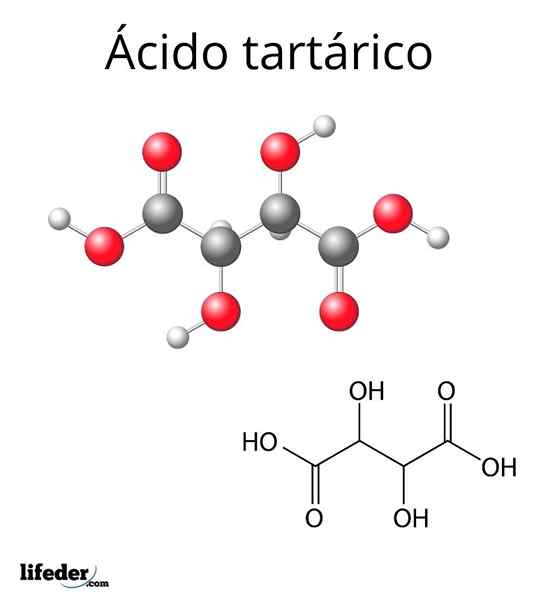
 Struttura molecolare dell'acido tartarico
Struttura molecolare dell'acido tartarico La struttura molecolare dell'acido tartarico è rappresentata nell'immagine superiore. I gruppi carbossilici (-cooh) si trovano alle estremità laterali e sono separati da una breve catena di carbonio (C2 e C3).
A sua volta, ognuno di questi carboni è collegato a una H (sfera bianca) e un gruppo OH. Questa struttura può ruotare il collegamento C2-C3, generando così diverse conformazioni che stabilizzano la molecola.
Cioè, il collegamento centrale della molecola rotta come cilindro rotante, alternando consecutivamente la disposizione spaziale dei gruppi -Cooh, H e OH (proiezioni di Newman).
Ad esempio, nell'immagine i due gruppi OH indicano in direzioni opposte, il che significa che sono in anti -posizioni tra loro. Lo stesso vale per i gruppi -Cooh.
Un'altra possibile conformazione è quella di un paio di gruppi eclissati, in cui entrambi i gruppi sono orientati nella stessa direzione. Queste conformazioni non svolgerebbero un ruolo importante nella struttura del composto se tutti i gruppi di carboni c2 e C3 Erano gli stessi.
Come in questo composto i quattro gruppi sono diversi (-cooh, oh, h e l'altro lato della molecola), i carboni sono asimmetrici (o chirali) e presentano la famosa attività ottica.
Il modo in cui i gruppi sono disposti in carbons2 e C3 di acido tartarico determina alcune strutture e proprietà diverse per lo stesso composto; cioè, consente l'esistenza di stereoisomeri.
Applicazioni di acido tartarico
Nell'industria alimentare
È usato come stabilizzatore di eulsion nei panetterie. Viene anche usato come ingrediente per lievito, marmellata, gelatina e bevande analcoliche. Esegue anche le funzioni come una biblioteca acidificante, una biblioteca e di ioni.
Può servirti: bromuro di sodio (NABR)L'acido tartarico si trova in questi alimenti: biscotti dolci, caramelle, cioccolatini, liquidi gassosi, prodotti da forno e vini.
Nell'elaborazione dei vini viene utilizzato per renderli più equilibrati, dal punto di vista gustatorio, diminuendo il pH di questi.
Nell'industria farmaceutica
È usato nella creazione di pillole, antibiotici e pillole effervescenti, nonché nelle medicine utilizzate nel trattamento delle malattie cardiache.
Nell'industria chimica
È usato in fotografia, così come in galvanotecnica ed è un antiossidante ideale per i grassi industriali.
Viene anche usato come rapitore di ioni metallici. COME? Ruotando i loro collegamenti in modo tale da poter individuare gli atomi di ossigeno del gruppo carbonilico, ricchi di elettroni, attorno a queste specie caricate positivamente.
Nel settore delle costruzioni
Ritardare il processo di indurimento in gesso, cemento e gesso, rendendo più efficiente la manipolazione di questi materiali.
Proprietà dell'acido tartarico

Le applicazioni di acido tartarico più comuni sono:
- L'acido tartarico è commercializzato sotto forma di polvere cristallina o cristalli bianchi leggermente opachi. Ha un gusto piacevole e questa proprietà è indicativa di un vino di buona qualità.
- Si scioglie a 206 ºC e brucia a 210 ºC. È molto solubile in acqua, alcoli, soluzioni di base e borace.
- La sua densità è di 1,79 g/ml a 18 ºC e presenta due costanti di acidità: PKA1 e pka2. Cioè, ciascuno dei due protoni acidi ha la sua tendenza a liberarsi nell'ambiente acquoso.
- AS ha fatto gruppi -co e OH, può essere analizzato mediante spettroscopia a infrarossi (IR) per le loro determinazioni qualitative e quantitative.
- Altre tecniche come la spettroscopia di massa e la risonanza magnetica nucleare consentono l'analisi precedente di questo composto.
Stereochimica

L'acido tartarico è stato il primo composto organico a cui è stata sviluppata una risoluzione enantiomerica. Cosa significa questo? Significa che i suoi stereoisomeri potrebbero essere separati manualmente grazie al lavoro di ricerca del biochimico Louis Pasteur, nel 1848.
E quali sono gli stereoisomeri dell'acido tartarico? Questi sono: (r, r), (s, s) e (r, s). R e s sono le configurazioni spaziali dei carboni C2 e C3.
L'acido tartarico (R, R), il più "naturale", ruota la luce polarizzata a destra; L'acido tartarico (S, S) è rotto a sinistra, contrariamente agli aghi dell'orologio. E infine, l'acido tartarico (R, S) non rompe la luce polarizzata, essendo otticamente inattivo.
Louis Pasteur, con l'aiuto di un microscopio e pinzette, ha trovato e separati cristalli di acido tartarico che hanno mostrato modelli "a destra" e "a sinistra", come nell'immagine superiore.
In questo modo, i cristalli "manuati" sono quelli formati dall'enantiomero (r, r), mentre i cristalli "a sinistra" sono quelli degli enantiomeri (s, s).
Tuttavia, i cristalli di acido tartarico (R, S) non differiscono dagli altri, poiché mostrano caratteristiche qualificate e sinistro allo stesso tempo; Pertanto, non potevano essere "risolti".
Riferimenti
- Wikipedia. (2018). Acido tartarico. Recuperato da.Wikipedia.org
- PUBCHEM. (2018). Acido tartarico. Recuperato da Pubchem.NCBI.Nlm.NIH.Gov.
- Comprensione dei tartati di vino. Recuperato da Jordanwinery.com
- Attivo. Acido tartarico. Recuperato da Actipedia.org
- Pochteca. Acido tartarico. Pochteca si è ripresa.com.MX
- Dhanesshwar Singh et al. (2012). Sull'origine dell'inattività ottica dell'acido meso-tartarico. Dipartimento di Chimica, Università di Manipur, Canchipur, Imphal, India. J. Chimica. Pharm. Manzo., 4 (2): 1123-1129.

