Struttura dell'acido solfonico, nomenclatura, proprietà, usi
- 4211
- 840
- Lidia Valentini
È chiamato acido solfonico A tutti i composti appartenenti a una famiglia di acidi organici che hanno uno o più gruppi, così3H. Alcuni autori indicano che il composto padre è H-S (= O)2-Oh, o H-così3H, chiamato da un "acido solfonico", tuttavia, la sua esistenza non è stata dimostrata, né quella del suo tautomero ho -s (= o) -oh noto come "acido zolfo" (h2SW3), né in soluzione né in stato solido.
Quest'ultimo è perché il gas di biossido di zolfo (IV) (SO2) In soluzione acquosa diventa ioni bisolfito (HSO3-) e pirosolfito (s2O52-) E non a h-s (= o)2-OH o Ho -s (= O) -OH, che è già stato dimostrato da molti ricercatori chimici.
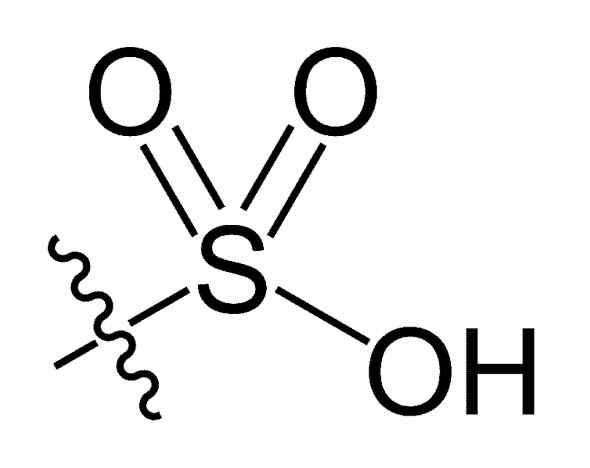
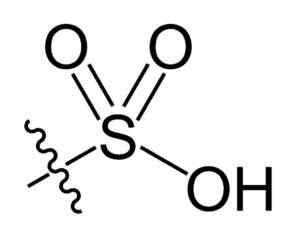 Gruppo di sulfonil. Choij [dominio pubblico]. Fonte: Wikipedia Commons
Gruppo di sulfonil. Choij [dominio pubblico]. Fonte: Wikipedia Commons Nella formula r-così chimica3H di acidi solfonici, il gruppo R può rappresentare scheletri di idrocarburi come alcano, alqueno, alchene e/o sabbia. Questi possono contenere funzionalità secondarie come estere, etere, chetone, amino, amido, idrossile, carbossil e fenoli, tra molti altri.
Gli acidi solfonici sono acidi forti, paragonabili all'acido solforico (H2SW4). Tuttavia, il resto delle sue proprietà dipende in gran parte dalla natura del gruppo R.
Alcuni hanno la tendenza a desolfonare ad alte temperature. Questo significa perdere il gruppo -so3H, specialmente quando r è un sabbioso, cioè con anello di benzene.
Gli acidi solfonici hanno molti usi a seconda della loro formula chimica. Sono usati per produrre coloranti, inchiostri, polimeri, detergenti, tensioattivi e come catalizzatori, tra molte altre applicazioni.
[TOC]
Struttura
Gli acidi solfonici hanno la seguente struttura generale:
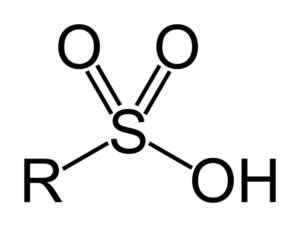 Formula generale di acidi solfonici. Benjah-BMM27 [dominio pubblico]. Fonte: Wikipedia Commons
Formula generale di acidi solfonici. Benjah-BMM27 [dominio pubblico]. Fonte: Wikipedia Commons Nomenclatura
- Gruppo di sulfonil: -so3H
- Acido affitto o arilsulfonico: R-SO3H
Proprietà
Sono solidi o liquidi a seconda del gruppo R. Non sono noti acidi di solfonici gassosi.
Le sue proprietà fisiche e chimiche dipendono dalla natura del gruppo r. Come confronto ci sono alcune proprietà fisiche di diversi acidi solfonici, dove p.F. È il punto di fusione e P.E. È il punto di ebollizione a una pressione di 1 mm Hg:
- Acido metanosolfonico: P.F. 20 ºC; P.E. 122 ºC
- Acido etanosofonico: p.F. -17 ºC; P.E. 123 ºC
- Acido proposulfonico: p.F. -37 ºC; P.E. 159 ºC
- Acido butanosolfonico: p.F. -15 ºC; P.E. 149 ºC
Può servirti: cloruro ferroso (FECL2): struttura, usi, proprietà- Acido pentosolfonico: p.F. -16 ºC; P.E. 163 ºC
- Acido esanosolfonico: P.F. 16 ºC; P.E. 174 ºC
- Acido benzefonico: p.F. 44 ºC; P.E. 172 ºC (a 0,1 mm Hg)
- Acido p-toluensulfonico: P.F. 106 ºC; P.E. 182 ºC (a 0,1 mm Hg)
- Acido 1-naftalesulnico: P.F. 78 ºC; P.E. Si decompone
- 2-naftalesulfonico: p.F. 91 ºC; P.E. Si decompone
- Acido trifluorometanosulfonico: p.F. nessuno; P.E. 162 ºC (a 760 mm Hg)
La maggior parte sono molto solubili in acqua.
Gli acidi solfonici sono ancora più acidi degli acidi carbossilici. Hanno acidità simile a quella dell'acido solforico. Si dissolvono in idrossido di sodio acquoso e bicarbonato acquoso.
Tendono a subire una decomposizione termica, avvenendo la loro desolfonazione. Tuttavia, molti degli acidi alcosolfonici sono termicamente stabili. In particolare, l'acido trifico o l'acido trifluorometansolfonico è uno degli acidi più forti e stabili.
Ottenimento
Acidi arilsulfonici
Gli acidi ailsulfonici sono generalmente ottenuti attraverso il processo di solfonazione che consiste nell'aggiungere un eccesso di acido solforico di fumo (H2SW4 + SW3) Al composto organico vogliamo Sulfonar. Ad esempio nel caso del benzene:
C6H6 + H2SW4 C6H5SW3H + H2O
ARH + H2SW4 Arso3H + H2O
La solfonazione è una reazione reversibile, perché se aggiungiamo all'acido benzeulfonico un acido diluito e passiamo il vapore sul mixt3 E il benzene viene distillato dalla volatilizzazione con vapore, spostando l'equilibrio verso la desolfonazione.
L'agente solfonante può anche essere acido clorosolfurico, acido solfamico o ioni solfito.
Acidi alchilofonici
Questi sono generalmente preparati mediante solfo-ossidazione, cioè il trattamento dei composti alchilici con biossido di zolfo così2 e ossigeno o2, o direttamente con il triossido di zolfo così3.
RH + 2SO2 + O2 + H2O r-so3H + H2SW4
Applicazioni
Acidi solfonici per tensioattivi e detergenti
Gli acidi alchibenfi sono usati nella produzione di detergenti, essendo uno degli usi più diffusi.
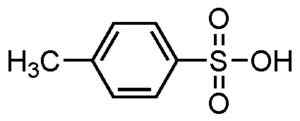 Acido p-metilbenzefonico. Su-No-g. Source = selfmade. *Data = 21 agosto 2006. *Made con ChemDraw. Fonte: Wikipedia Commons.
Acido p-metilbenzefonico. Su-No-g. Source = selfmade. *Data = 21 agosto 2006. *Made con ChemDraw. Fonte: Wikipedia Commons. Sono usati per detergenti in polvere e liquido, detergenti per compiti pesanti o chiari, mani e saponi di shampoo.
I componenti attivi sono generalmente gli esteri grassi lineari e solfonati alchibenzene.
Poiché i tensioattivi sono alfa-olefina solfonati, solfobetine, solfosuccinati e étere in affitto diffenile, tutti derivati dagli acidi solfonici.
Può servirti: ossalato di sodio (Na2c2o4): struttura, proprietà, usi, rischiQuesti tensioattivi trovano uso nei prodotti per la pulizia delle famiglie, i cosmetici, la polimerizzazione nelle emulsioni e la produzione chimica per l'agricoltura.
I ligosolfonati sono derivati dal solfonato dalla lignina, un componente del legno, e sono usati come agenti dispersi, idratanti e leganti nei marciapiedi stradali, additivi in cemento e additivi negli alimenti animali.
Viene utilizzato un acido 2-naftalanosolfonico derivato per aumentare la fluidità del cemento e la resistenza.
Colorazione basata su acido solfonico
Questi sono generalmente caratterizzati da gruppi AZO (R-N = N-R).
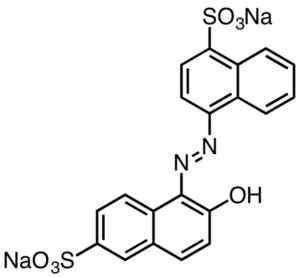 Colorazione rossa acida. Fumofoot [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)]. Fonte: Wikipedia Commons.
Colorazione rossa acida. Fumofoot [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)]. Fonte: Wikipedia Commons. I coloranti derivati dall'acido solfonico hanno utilità nell'industria della carta, inchiostri come stampa di iniezione, tessuti come cotone e lana, cosmetici, saponi, detergenti, cibo e pelle.
Un derivato dell'acido 2-naftalanosolfonico è anche usato come ingrediente da colorare per fibre di poliestere e abbronzatura in pelle.
Amide basate su acidi solfonici
Questa applicazione evidenzia gli acidi acrilamidefonici, che hanno i polimeri che usano, in elettrodi metallici, come tensioattivi e in rivestire anti -compagnia.
Sono anche utilizzati per un miglioramento del recupero dell'olio, come agenti di biberazione composti sul suolo, in miscele di cemento idraulico e come resine aminoplastiche che curitano gli acceleratori.
Alcuni sulfonamidi sono usati anche nelle formule di insetticidi.
Acidi solfonici fluorurati e clorofluoli
Questo gruppo evidenzia l'acido trifluorometanosulfonico (CF3SW3H), chiamato anche acido trifico. Questo composto ha una catalisi organica di sintesi e polimerizzazione.
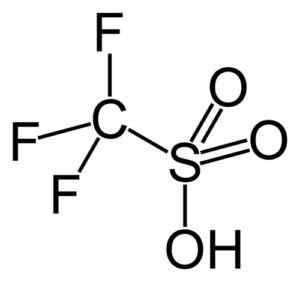 Acido trifico. Capacio [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Fonte: Wikipedia Commons.
Acido trifico. Capacio [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Fonte: Wikipedia Commons. Ad esempio, viene utilizzato nella polimerizzazione delle olefine aromatiche e nella preparazione di idrocarburi paraffinici altamente ramificati con un numero di ottano elevato per usarli come additivi del carburante.
Un'altra delle sue applicazioni è nella sintesi di polimeri conduttivi, per mezzo di doping di poliacetilene, producendo, ad esempio, semiconduttori di tipo P.
Acido pentafluoroetanosulfonico (CF3Cf2SW3H), noto come acido pentaplic, è usato come catalizzatore organico.
L'acido trifico sta reagendo con il pentafluoruro di antimonio (SBF5) Generando il "acido magico" così chiamato, un catalizzatore super -acido che serve per l'alchilazione e la polimerizzazione.
Può servirti: tintura di iodio: proprietà, usi, controindicazioniNafion-H è una resina a scambio ionico di un acido polimero solfonico profumato. Ha la caratteristica di essere inerte verso acidi forti, basi forti e riduzioni o ossidanti.
In applicazioni biologiche
Uno dei pochi acidi solfonici trovati in natura è l'acido 2-aminoetanosulfonico, meglio noto come corrida, un aminoacido essenzialmente in particolare per i gatti.
La corrida sintetica e naturale viene utilizzata come integratori negli alimenti per animali domestici e prodotti farmaceutici.
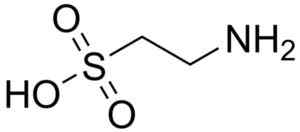 Molecola di corrida. Nutrinare. Fonte: Wikipedia Commons
Molecola di corrida. Nutrinare. Fonte: Wikipedia Commons L'acido taurocolico è un componente biliare e partecipa alla digestione dei grassi. L'acido 8-anilino-1-naftalanosolfonico, un composto sintetico, viene utilizzato nello studio delle proteine.
I copolimeri di urea e l'acido bifenildisolfonico sono stati usati come inibitori del virus dell'herpes simplex.
Alcuni derivati dell'acido solfonico, come il polistirene solfonato e alcuni azocompiestos, hanno mostrato proprietà di inibizione dell'immunodeficienza umana o del virus dell'HIV, senza essere eccessivamente tossici contro le cellule ospiti.
Nell'industria petrolifera
Alcune miscele di derivati dell'olio, che includono una variegata combinazione di aromatici, paraffine e aromatici polinucleari, possono essere solfonate e quindi correttamente neutralizzate generando i solfonati di petrolio così chiamati.
Questi solfonati di petrolio hanno la proprietà di abbassare la tensione di chirurgia in acqua. Inoltre, la sua produzione ha un costo molto basso.
Per questo motivo, i solfonati di petrolio vengono iniettati nei pozzi di petrolio esistenti che aiutano il recupero di petrolio greggio che viene occluso tra le rocce sotto la superficie.
Nella formulazione di lubrificanti e anticorrosivi
I solfonati di magnesio hanno un ampio uso in formule lubrificanti come additivi da dispersione e per evitare l'usura.
I solfonati di bario sono usati nei lubrificanti anti -flusso per usati utilizzati in applicazioni ad alta velocità. I solfonati di sodio e calcio hanno lubrificanti e grassi grassi per migliorare le proprietà di pressione estrema.
I sali di magnesio dell'acido solfonico sono utili anche in applicazioni anticorrosive come rivestimenti, grassi e resine.
Riferimenti
- Falk, Michael e Giguere, Paul A. (1958). Sulla natura dell'acido solforoso. Canadian Journal of Chemistry, Vol. 36, 1958. Recuperato da NRCreSearchPress.com
- Betts, r.H. e voss, r.H. (1970). La cinetica dell'ossigeno si scambia tra ioni solfito e acqua. Canadian Journal of Chemistry, Vol. 48, 1970. Recuperato da NRCreSearchPress.com
- Cotone, f.A. E Wilkinson, G. (1980). Chimica inorganica avanzata. Quarta edizione. Capitolo 16. John Wiley & Sons.
- Kirk-Othmer (1994). Enciclopedia della tecnologia chimica. Volume 23. Quarta edizione. John Wiley & Sons.
- Kosswig, Kurt. (2012). Tensioattivi. L'Enciclopedia di Chimica industriale di Ullmann Vol. 35. Wiley-VCH Verlag GmbH & Co.
- « Struttura, usi, ottimo, proprietà, proprietà, proprietà, ottimo
- Struttura dell'acido poliattico, proprietà, sintesi, usi »

