Acido selenidrico (H2SE) cosa è, struttura, proprietà, usi
- 1122
- 275
- Rosolino Santoro
 Idrogeno seleniuro: due molecole di idrogeno e uno di selenio
Idrogeno seleniuro: due molecole di idrogeno e uno di selenio Cos'è l'acido selenidrico?
Lui Acido selenidrico o Idrogeno seleniuro è un composto inorganico la cui formula chimica è h2LUI. È di natura covalente e in condizioni di temperatura e pressione ordinarie è un gas incolore; Ma con un forte odore riconoscibile della sua presenza minore. Chimicamente, è una trazione, quindi il selenio ha valencia di -2 (i2-).
Di tutti i seleniuros, h2È il più tossico perché la sua molecola è piccola e il suo atomo di selenio ha meno ostacoli sterici quando reagisce. D'altra parte, il suo odore consente a coloro che lavorano con esso di rilevarlo nell'atto in caso di esterno alla campana di laboratorio.
L'idrogeno seleniuro può sintetizzare mediante la combinazione diretta dei suoi due elementi: idrogeno molecolare, h2, e selenio metallico. Può anche essere ottenuto mediante composti dissolventi ricchi di selenio, come il ferro seleniuro (II), FESE, in acido cloridrico.
D'altra parte, l'acido selenidrico viene preparato dissolvendo l'idrogeno seniuro in acqua; Cioè, il primo viene sciolto nell'acqua, mentre il secondo è costituito da bevande analcoliche.
Il suo uso principale è quello di essere una fonte di selenio nella sintesi organica e inorganica.
Struttura di idrogeno seleniuro
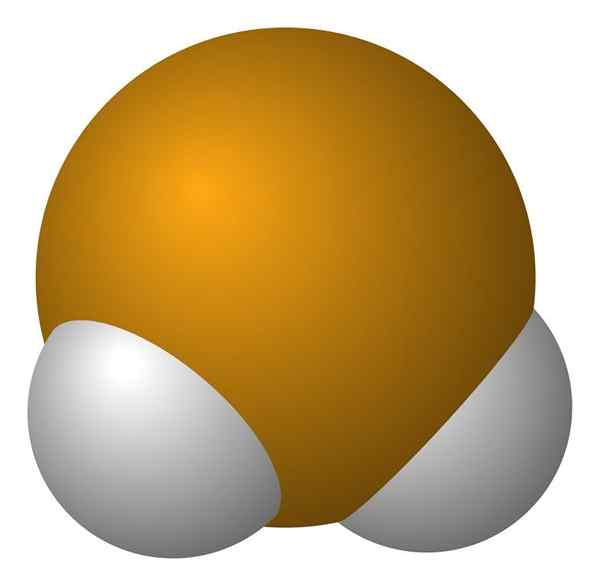
 Molecola di idrogeno seleniuro. Wikimedia Commons.
Molecola di idrogeno seleniuro. Wikimedia Commons. La molecula H2È di geometria angolare, sebbene il suo angolo di 91 ° lo faccia sembrare più simile a una L che a una V. In questo modello di sfere e barre, gli atomi di idrogeno e il selenio sono rispettivamente le sfere bianche e gialle.
Questa molecola, come mostrato, è quella in una fase gassosa; cioè, per l'idrogeno seleniuro. Quando si dissolve in acqua, rilascia un protone e in soluzione hai la coppia HSE- H3O+; Questa coppia di ioni arriva all'acido selenidrico, indicato come h2SE (AC) per differenziarlo dall'idrogeno seleniuro, h2SE (G).
Può servirti: blu di metilene: caratteristiche, preparazione, usi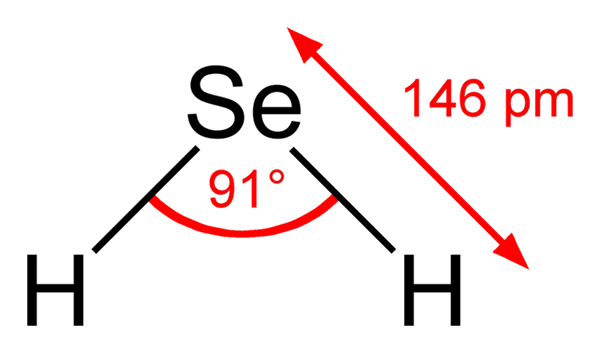 Formula strutturale di acido seleenidrico. Ben Mills, Wikimedia Commons ..
Formula strutturale di acido seleenidrico. Ben Mills, Wikimedia Commons .. Pertanto, le strutture tra H2SE (AC) e H2Se (g) sono molto diversi; Il primo è circondato da una sfera acquosa e ha carichi ionici e il secondo è costituito da un agglomerato di molecole di fase gassosa.
Le molecole H2Possono a malapena interagire tra loro attraverso forze molto deboli dipolo-dipolo. Il selenio, sebbene sia meno elettronegativo di quanto lo zolfo concentri una maggiore densità elettronica a "strapparlo" dagli atomi di idrogeno.
Selenio idrue compresso
Se le molecole H2Subiscono una pressione straordinaria (centinaia di GPA), teoricamente sono costretti a solidificarsi formando collegamenti SE-H-SE; Questi sono collegamenti di tre centri e due elettroni (3C-2E) dove partecipa l'idrogeno. Pertanto, le molecole iniziano a formare strutture polimeriche che definiscono un solido.
In queste condizioni, il solido con più idrogeno può essere arricchito, il che modifica completamente le strutture risultanti. Inoltre, la composizione diventa Tipo HNSe, dove n varia da 3 a 6. Pertanto, gli idruri di selenio compressi da queste pressioni e in presenza di idrogeno hanno formule chimiche H3Lo so h6LUI.
Si stima che questi idrori di selenio arricchiti con idrogeno abbiano proprietà superconduttivi.
Proprietà
Aspetto fisico
Gas incolore che a basse temperature odora di uova putrefacto e marce se la sua concentrazione aumenta. Il suo odore è peggiore e più intenso dell'idrogeno solforato (che è già abbastanza spiacevole). Tuttavia, questo è buono, poiché aiuta a rilevare facile e riduce i rischi di contatto o inalazione prolungati.
Quando brucia, emette un prodotto bluastro di fiamma delle interazioni elettroniche negli atomi di selenio.
Può servirti: ossido di zolfoMassa molecolare
80,98 g/mol.
Punto di ebollizione
-41 ° C.
Punto di fusione
-66 ° C.
Pressione del vapore
9,5 atm a 21 ° C.
Densità
3.553 g/l.
PkA
3.89.
Solubilità dell'acqua
0,70 g/100 ml. Ciò conferma il fatto che l'atomo di selenio di H2Non puoi formare ponti idrogeno apprezzabili con molecole d'acqua.
Solubilità in altri solventi
-Solubile in CS2, che non sorprende dall'analogia chimica tra selenio e zolfo.
-Phosgen Soluble (a basse temperature, in quanto bolle a 8 ° C).
Nomenclatura
Come spiegato nelle sezioni precedenti, il nome di questo composto varia a seconda che h2È in una fase di soda o disciolta in acqua. Quando è in acqua, si parla di acido seleenidrico, che non è altro che un'idrazia in termini inorganici. A differenza delle molecole di gas, il suo carattere acido è maggiore.
Tuttavia, sia come gas che sciolto in acqua, l'atomo di selenio mantiene le stesse caratteristiche elettroniche; Ad esempio, il suo valencia è -2, a meno che tu non subisca una reazione di ossidazione. Questo valencia di -2 è il motivo per cui si chiama Seleniaurochs di idrogeno, poiché l'anione Seleniuro è il2-; che è più reattivo e riduttore della s2-, solfuro.
Se viene utilizzata la nomenclatura sistematica, è necessario specificare il numero di atomi di idrogeno nel composto. Quindi, h2Si chiama: Seleniuro di ha datoidrogeno.
Seleniuro o idruro?
Alcune fonti si riferiscono a lui come un idruro. Se lo fosse davvero, il selenio avrebbe una carica positiva +2 e il carico idrogeno -1: SEH2 (LUI2+, H-). Il selenio è un atomo più elettronegativo dell'idrogeno e quindi termina "monopolizzando" la più alta densità elettronica nella molecola H2LUI.
Può servirti: termochimicaTuttavia, in quanto tale, l'esistenza di idruro di selenio non può essere scartata. In effetti, con la presenza di anioni H- Faciliterebbe i collegamenti SE-H-SE, responsabili di strutture solide formate a enormi pressioni secondo gli studi informatici.
Applicazioni
Metabolico
Sebbene sembri contraddittorio, nonostante la grande tossicità di H2Se, è prodotto nel corpo sulla via metabolica del selenio. Tuttavia, le cellule sono appena prodotte come intermediario nel syntium delle senioproteine o finiscono per essere metilate ed escrete; Uno dei sintomi di questo è il sapore all'aglio in bocca.
Industriali
Il h2Viene utilizzato principalmente per aggiungere atomi di selenio a strutture solide, come i materiali a semiconduttore; alle molecole organiche, come alcheni e nitrili per la sintesi di seleniuros organici; o per una soluzione per precipitare seleniuros metallici.
Riferimenti
- Selenide idrogeno. Recuperato da: in.Wikipedia.org
- Selenide idrogeno, h2LUI. Recuperato da: selenio.Atomistrica.com

