Struttura dell'acido perracetico, proprietà, ottenimento, usi
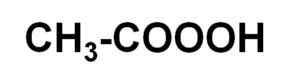
- 1467
- 258
- Rufo Longo
Lui acido paracetico È un composto organico liquido la cui formula chimica è C2H4O3. È perossido di acido acetico, quindi è anche noto come acido perxiacetico. La sua molecola è simile a quella dell'acido acetico CH3COOH ma con un ulteriore ossigeno in carbossil.
Appartiene alla classe di perossidi organici, che sono molecole fatte dall'uomo. Le proprietà germicide e sterilizzanti delle loro soluzioni acquose sono conosciute dal 1902. Questa azione può in alcuni casi di esercitare a concentrazioni fino allo 0,001%.
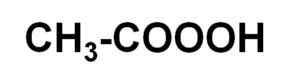 Acido paracetico. Autore: Marilú Stea.
Acido paracetico. Autore: Marilú Stea. Questa proprietà lo rende ampiamente utilizzato in cliniche e ospedali per sterilizzare le attrezzature mediche, con il vantaggio aggiuntivo che i loro prodotti di decomposizione non sono tossici per l'essere umano.
Le soluzioni PAA sono fortemente ossidanti, una caratteristica che è stata utilizzata per candeggiare la polpa di carta o la lavanderie. Si applica anche all'esecuzione di reazioni chimiche in cui è richiesta questa proprietà, come la epossidazione e l'idrossilazione.
La sua azione ossidante e disinfettante è utilizzata nella pulizia delle attrezzature in cui vengono elaborati alimenti e bevande. Inoltre, è corrosivo per alcuni metalli e quando conservato deve essere tenuto lontano da composti organici o facilmente ossidabili.
Fare riferimento che le soluzioni concentrate possono essere esplosive, motivo per cui deve preferibilmente prepararsi e conservare in luoghi freddi. La sua forza corrosiva si applica anche alla pelle, alle mucose e ai tessuti dell'essere umano, quindi deve essere manipolata con cautela e con attrezzature protettive.
[TOC]
Struttura
L'acido perxiacetico ha una molecola molto simile a quella dell'acido acetico ma con un ulteriore ossigeno nella struttura del gruppo -cooh, poiché ha 3 atomi di ossigeno anziché due.
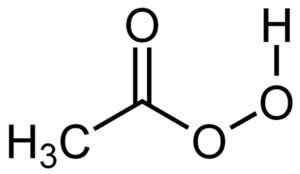 Struttura dell'acido teracetico. Autore: Su-No-g. Fonte: autoprodotto. Fonte: Wikipedia Commons.
Struttura dell'acido teracetico. Autore: Su-No-g. Fonte: autoprodotto. Fonte: Wikipedia Commons. Nomenclatura
- Acido paracetico
- Acido perxiacetico
- Acido etanooperoxoico
- PAA (acronimo inglese Acido perossacetico).
Proprietà
Stato fisico
Liquido chiaro incolore con un forte odore di aceto.
Peso molecolare
76,05 g/mol
Punto di ebollizione
110 ºC (con esplosione)
Punto d'infiammabilità
40,5 ºC (metodo di coppa aperta)
Temperatura di auto-direzione
200 ºC (è la temperatura a spontaneamente)
Densità
1.226 g/cm3 a 15 ºC
Sostanza vischiosa
3.280 cp a 25,6 ºC
Indice di rifrazione
1.3974 a 20 ºC
Solubilità
È miscibile con l'acqua in qualsiasi proporzione. È solubile in solventi organici polari, come l'etanolo. Leggermente solubile in solventi aromatici. Molto solubile in etere e acido solforico.
ph
Meno di 2.
Costante di dissociazione
PkA = Da 8,20 a 25 ºC (è più debole dell'acido acetico di PKA = 4.8)
Proprietà chimiche
Come acido, il PAA è molto più debole dell'acido da cui proviene l'acido acetico.
Presenta un alto potenziale come ossidante. È altamente reattivo, quindi è difficile da archiviare e questo ha limitato il suo uso.
I suoi prodotti di degradazione sono acido acetico CH3Cooh, ossigeno o2, Perossido di idrogeno H2O2 e acqua h2O. Il h2O2 a sua volta si degrada in acqua e ossigeno. Tutti questi composti sono al sicuro ecologico.
È un agente epossidante e idroassilato per legami olefinici (doppi collegamenti C = C). Ciò significa che partecipa attivamente alla formazione di epossidi in doppi legami di molecole organiche e all'aggiunta di gruppi -OH in questi.
Il PAA è corrosivo verso alcuni metalli come acciaio liscio, ferro zincato, rame, ottone e bronzo. Altri metalli sono resistenti come acciaio inossidabile, alluminio puro e ferro tessuto.
Può servirti: composto chimicoAttaccare gengive sintetiche e naturali ed estrarre il plastificante di alcuni polimeri in vinile.
Ha un odore acuto e acro che ricorda quello dell'acido acetico (l'acido acetico è il componente principale dell'aceto).
Ottenimento
Reagendo l'acido acetico glaciale (anidro, cioè senza acqua) con perossido di idrogeno H2O2 In presenza di un acido minerale (come l'acido solforico H2SW4), parte delle soluzioni ossidate e acquose di acido acetico di acido pertura, acido acetico e h si ottengono2O2.
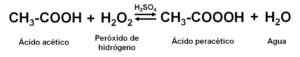 Ottenere soluzioni acquose di acido perture. Autore: Marilú Stea
Ottenere soluzioni acquose di acido perture. Autore: Marilú Stea Il h2SW4 Agisce come un catalizzatore o un acceleratore di reazione. Vengono utilizzati agenti stabilizzanti, come l'acido piridina-2,6-dicarbossilico.
Se queste soluzioni vengono distillate, è possibile ottenere una maggiore concentrazione di perture.
Può anche essere ottenuto mediante ossidazione di acetaldeide ch3CHO con ozono o3, o per reazione dell'anidride acetica (CH3CO)2O con h2O2.
Un altro modo per ottenerlo direttamente nel sito dove è richiesto è aggiungendo tetra-acetil-etilendiamina (TAED) a una soluzione alcalina di H2O2.
Applicazioni
In medicina come sterilizzatore dell'attrezzatura
Il PAA funge da disinfettante di attrezzature mediche in cliniche, ospedali, uffici medici e dentali.
 Attrezzatura dentale sterilizzata. Autore: Daniel Frank. Fonte: Pexels.
Attrezzatura dentale sterilizzata. Autore: Daniel Frank. Fonte: Pexels. Alcune fonti riportano che la loro azione contro i microrganismi può essere classificata e: batteri> virus> spore di batteri> cisti protozoi. Ciò significa che è più efficace contro i batteri e meno efficace contro le cisti protozoi.
Negli studi condotti sull'azione battericida del PAA e altri disinfettanti di alto livello contro Staphylococcus aureus E Pseudomonas aeruginosa Nell'attrezzatura per l'endoscopia, il PAA si è rivelato il più veloce nel suo effetto microbicida.
Lui Staphylococcus aureus Può produrre infezioni nei tessuti molli, nella pelle, nella polmonite e nell'infezione dei tessuti cardiaci. IL Pseudomonas aeruginosa Può produrre polmonite.
I batteri formano biofilm che li proteggono da stimoli o stress esterni, attraverso uno spesso strato di proteine extracellulari, polisaccaridi e acidi nucleici.
Questi biofilm sono altamente resistenti agli antibiotici e ai disinfettanti comuni. In team come gli endoscopi si formano solitamente nei loro canali stretti, a causa di routine di pulizia e disinfezione non adeguate o non efficaci.
PAA attacca questi biofilm probabilmente per ossidazione dei più sensibili legami molecolari di proteine, enzimi e altri metaboliti. Questo porta alla rottura delle pareti cellulari dei germi, delle loro spore e cisti.
Inoltre, quando penetra nella cellula, il PAA può ossidare gli enzimi essenziali, danneggiando il trasporto di molecole e processi biochimici vitali.
I tempi di disinfezione sono stati stabiliti per alcuni anni, ma durante alcuni studi è stato osservato che il trattamento PAA ha causato cambiamenti nella forma delle cellule dopo soli 5 minuti, con formazione di sacchetti o rigonfiamenti nella parete cellulare dei batteri e crollo del cellulare Strutture di microrganismi dopo 30 minuti.
Sebbene il PAA si sia distinto per la loro velocità, i ricercatori hanno raccomandato di rivalutare i tempi stabiliti nei protocolli di pulizia e disinfezione, aumentandoli per la maggior parte degli antisettici di alto livello, per garantire l'efficacia totale di questi.
Uno degli aspetti negativi del PAA è che ci sono alcuni agenti patogeni verso i quali non è molto efficace, come le cisti del Giardia lamblia "non e 'Inglese e di Cryptosporidium parvum (parassiti che possono produrre diarrea o altre condizioni intestinali).
Nel trattamento delle acque reflue
L'effetto disinfettante del PAA sulle acque reflue o le industrie municipali è stato studiato da più di 30 anni.
Può servirti: idruro di potassio: struttura, formazione, proprietà Impianto di trattamento delle acque residuo. Autore: Michal Jarmoluk. Fonte: Pixabay.
Impianto di trattamento delle acque residuo. Autore: Michal Jarmoluk. Fonte: Pixabay. Tra i suoi vantaggi c'è l'ampio spettro della sua attività germicida anche in presenza di materia organica, nonché il fatto che non vengono generati prodotti secondari dannosi per l'ambiente.
L'efficacia della sua azione sembra dipendere tra gli altri fattori della quantità di materia organica presente nell'effluente, dal tipo e dalla quantità di microrganismi da eliminare, dalla concentrazione del PAA nell'acqua da trattare, il pH e il pH durata del trattamento.
In alcuni casi, la PAA si è dimostrata migliore dell'ipoclorito di sodio per disinfettare le acque reflue nei climi tropicali ed è stato efficace contro il virus del colera, tra molti altri agenti patogeni.
Tuttavia, uno dei punti negativi è quello a causa del restante acido acetico dopo la disinfezione, l'effluente idrico è caricato di materia organica, il che aumenta il rischio di una nuova crescita dei microrganismi.
D'altra parte, è un prodotto costoso, quindi non è ancora molto competitivo, ad esempio con ipoclorito di sodio a causa di questo aspetto.
Nell'industria alimentare
Essere un forte agente ossidante è molto efficace contro i microrganismi a basse temperature e questo ha dato origine al suo ampio uso come battericida e fungicida nella lavorazione degli alimenti e delle bevande.
Ciò include piante di lavorazione di carne e pollo, latticini, birrerie, viticoltori o cantine di vino e bevande analcoliche. In tutti questi luoghi il PAA richiede l'ideale per la pulizia Sul posto (nel posto).
Gli enzimi trovati in alcuni alimenti come la perossidasi e la catalasi, che disattivano il perossido di idrogeno H2O2, Non esercitano un effetto dannoso sull'acido pertura. Anche i rifiuti proteici non lo danneggiano.
A causa del fatto che nel cibo il PAA si decompone nell'acido acetico e nell'idrogeno, il suo uso è considerato sicuro nelle applicazioni in cui il cibo non viene sciacquato.
Funge da disinfettante e sterilizzante per serbatoi in acciaio inossidabile e vetro, tubi e camion di carro armato, che servono per il trasporto e lo stoccaggio di bevande.
 Serbatoi in acciaio inossidabile per conservare la birra. Autore: Roberta Keiko Kitahara Santana. Fonte: Unspash.
Serbatoi in acciaio inossidabile per conservare la birra. Autore: Roberta Keiko Kitahara Santana. Fonte: Unspash. La sua caratteristica di generare prodotti non totossici e che in alta diluizione non producono sapori o odori, costituiscono risparmi di tempo e denaro per questi settori.
Nell'industria della polpa e della carta
L'acido perracetico è un importante agente senza cloro nella tecnologia dello sbiancamento nel settore della produzione di polpette di carta.
Alcuni autori considerano l'acido peracetico come un derivato attivato di H2O2, Dove uno degli idrogeni di questo è stato sostituito da un gruppo CH Acilo3C (= o)-.
Come risultato di ciò, l'acido perture reagisce con substrati organici in misura maggiore di H2O2 e questo può essere usato nelle reazioni di ossidazione in condizioni più moderate rispetto a H2O2.
In condizioni neutre o moderatamente alcaline lo ione percetato CH3C (= o) oo- per essere un forte nucleofilo (è attratto da atomi carenti di elettroni), mescolare selettivamente cromofori o composti colorati presenti nella polpa di carta.
Ciò consente a queste industrie di avere una candeggina molto efficace e i cui rifiuti non inquinano i loro effluenti acquosi.
Può servirti: qual è l'erristoo?Nella produzione di altri composti chimici
L'acido perracetico funge da ossidante per preparare composti epossidici, come catalizzatore per produrre resine in poliestere e ottenere caprolattam e glicerolo.
Nel recupero di polimeri da riciclare
Alcuni ricercatori sono riusciti a recuperare materiali utili durante il trattamento di determinati rifiuti polimerici con soluzioni PAA.
Il processo viene effettuato mediante ossidazione di alcuni rifiuti di polimeri rinforzati con fibra di carbonio da attività aerospaziali, con soluzioni di acido acetico glaciale e perossido di idrogeno.
In questo modo, viene generato l'acido perture Sul posto, che rompe la resina epossidica del 97% lasciando intatta la fibra di carbonio.
Quindi, per distillazione viene recuperato oltre il 90% dell'acido acetico, con conseguente ulteriore decomposizione del polimero che genera composti alifatici e fenolici recuperabili.
La fibra di carbonio è ottenuta pulita e mantiene la sua resistenza di lunghezza e trazione paragonabile a quelle delle fibre vergini.
 Fibra di carbonio. CJP24 [dominio pubblico]. Fonte: Wikipedia Commons.
Fibra di carbonio. CJP24 [dominio pubblico]. Fonte: Wikipedia Commons. Il processo viene eseguito in condizioni morbide, senza emissioni gassose, il che lo rende ecologico.
In lavanderia
A causa della sua potenza ossidante di composti colorati, l'acido percetico viene utilizzato nella sbiancamento del bucato. In questi casi, viene utilizzata la miscela tetra-atl-etilendiamina con H2O2 In mezzo alcalino per ottenerlo sul sito.
Il suo intervallo di applicazione è molto ampio, in quanto può essere utilizzato in acque dure o che contengono elevata percentuale di sali di calcio e magnesio, a pH tra 3,0 e 7,5 e temperature da 0 a 40 ° C.
Rischi
L'acido perracetico o il PAA può essere altamente corrosivo. È fortemente irritante per la pelle e gli occhi.
Se le loro soluzioni vengono ingerite causano la corrosione delle mucose di bocca, gola, esofago e tratto gastrointestinale, causando dolore e difficoltà a deglutire.
Se i loro vapori vengono inalati.
Le soluzioni contengono. Possono decomporsi in modo esplosivo. Se la concentrazione di PAA in soluzione supera il 56% può innescare a causa dell'evaporazione violenta dell'acido acetico.
Il calore dovrebbe essere evitato. È considerato un liquido infiammabile. La sua decomposizione è violenta con esplosione a 110 ºC. Deve essere conservato in luoghi freschi, preferibilmente sotto il raffreddamento o in luoghi molto ben ventilati.
È fortemente ossidante, quindi, pericoloso in contatto con materiali organici. Se conservato, deve essere isolato da altri composti, in particolare composti organici, combustibili, infiammabili o ossidabili. Deve essere separato da acidi, alcali e metalli pesanti.
Se riscaldato alla decomposizione emette acri e vapori irritanti, che irritano gli occhi, il naso e la gola.
Se viene versato, non dovrebbe essere permesso di fluire verso gli scarichi perché in questi viene creato un pericolo di fuoco o esplosione.
Come misure preventive per la manipolazione, guanti di gomma e indumenti protettivi, scudo del viso o protezione degli occhi (occhiali o occhiali di sicurezza), protezione respiratoria e non mangiare, bere o fumare durante il lavoro con le loro soluzioni.
Riferimenti
- O.S. Biblioteca nazionale di medicina. (2019). Acido paracetico. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov
- Das, m. et al. (2018). Un metodo efficiente di reiccio di rifiuti CFRP usando acido percetico. ACS Chimica e ingegneria sostenibile. Recuperato dai pub.sindrome coronarica acuta.org.
- Cinese, t. et al. (2017). Effetti morfologici ad azione rapida battericida di acido percetico, un disinfettante di alto livello, contro Staphylococcus aureus E Pseudomcas aeruginosi Biofilm nei tubi. Antimicrob resiste al controllo infetto. 2017: 6: 122. NCBI recuperato.Nlm.NIH.Gov.
- Pane, g.X. et al. (1999). Reattività dell'acido ferulico e il suo deriva verso l'idrogeno posa e acido peracico. J. Agr. CHEM alimentare. 1999, 47, 3325-3331. Recuperato dai pub.sindrome coronarica acuta.org.
- Kitis, Mehmet. (2004). Dissinfezione delle acque reflue con acido percetico: una revisione. Environment International 30 (2004) 47-55. Recuperato da ScienceDirect.com.
- « Struttura dell'acido fenilacetico, proprietà, usi, effetti
- Caratteristiche del pensiero verticale, metodo ed esempi »

