Acido píchric che cosa è, struttura, sintesi, proprietà
- 2932
- 85
- Dott. Rodolfo Gatti
Lui Acido píchric È un composto chimico organico altamente Nitrado il cui nome Iupac è 2,4,6-trinitrofenolo. La sua formula molecolare è C6H2(NO2)3OH. È un fenolo molto acido e può essere trovato come picrato di sodio, ammonio o potassio; cioè, nella sua forma ionica C6H2(NO2)3Ona.
È un solido assaggio di un forte sapore di amaro, e da lì deriva il suo nome, dalla parola greca "Prikos", che significa amaro. Si trova come cristalli gialli bagnati. La sua essiccazione o disidratazione è pericolosa, poiché aumenta le proprietà instabili che lo rendono esplosivo.
L'acido píchric viene usato come base per la sintesi di coloranti permanenti di tono giallo. Alcuni patologi e ricercatori lo usano nella fissazione o nella colorazione delle sezioni tissutali e di altri processi immunoistochimici.
È molto utile nello sviluppo di prodotti farmaceutici. Inoltre, viene utilizzato nell'elaborazione di partite o partite ed esplosivi. Viene anche utilizzato per registrare i metalli, per creare vetro colorato e nella determinazione colorimetrica di parametri biologici come la creatinina.
Struttura
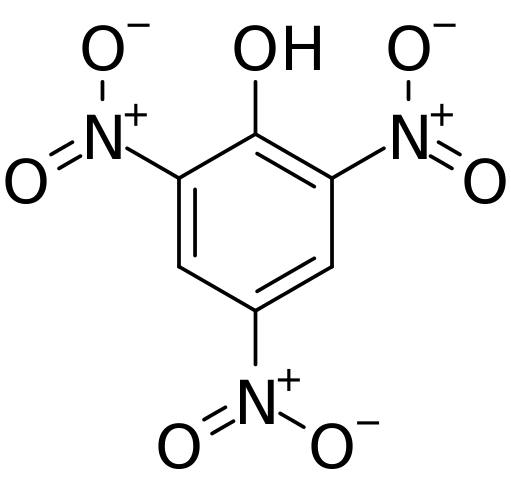
 Struttura e carichi formali in acido pichorico. Fonte: CVF-PS [dominio pubblico]
Struttura e carichi formali in acido pichorico. Fonte: CVF-PS [dominio pubblico] Nell'immagine superiore tutti i legami e la struttura in sé della molecola di acido píchric sono mostrati in modo più dettagliato. È costituito da un fenolo con tre sostituenti nitro.
Si può vedere che in gruppo no2 L'atomo di azoto ha un carico parziale positivo, e quindi la domanda di densità elettronica da ciò che circondava. Ma l'anello aromatico attira anche gli elettroni verso se stesso e prima dei tre no2 finisce per dare parte della propria densità elettronica.
Di conseguenza, l'ossigeno del gruppo OH tende più a condividere uno dei suoi coetanei elettronici liberi per fornire la carenza elettronica subita dall'anello; E in tal modo, il link c = o è formato+-H. Questo carico parziale positivo nell'ossigeno indebolisce il legame O-H e l'acidità aumenta; Cioè, verrà rilasciato come ioni idrogeno, h+.
Fenolo acido
È per questo motivo che questo composto è un acido (e reagente) eccezionalmente forte, anche più dell'acido acetico stesso. Tuttavia, il composto è in realtà un fenolo la cui acidità supera quella degli altri fenoli; Due, come ha appena detto, i sostituenti no2.
Può servirti: processi termodinamiciPertanto, poiché è un fenolo, il gruppo OH ha la priorità e dirige l'enumerazione nella struttura. I tre no2 Si trovano in carbons 2, 4 e 6 dell'anello aromatico rispetto a OH. Da qui deriva la nomenclatura IUPAC per questo composto: 2,4,6-trinitrofenolo (TNP).
Se i gruppi non lo fossero2, O se ci fossero un numero minore di loro nell'anello, il collegamento O-H indebolirebbe meno, e quindi il composto avrebbe meno acidità.
Struttura cristallina
Le molecole di acido pycric sono ordinate in modo tale da favorire le loro interazioni intermolecolari; o per la formazione di ponti idrogeno tra i gruppi OH e non2, Forze dipolo-dipolo o repulsioni elettrostatiche tra le regioni di elettroni poveri.
Ci si potrebbe aspettare che i gruppi non lo facciano2 Si respingono a vicenda e guida nella direzione degli anelli aromatici vicini. Allo stesso modo, gli anelli non potevano allineare uno sopra l'altro a causa di un aumento delle repulsioni elettrostatiche.
Come risultato di tutte queste interazioni, l'acido píchric riesce a formare una rete tridimensionale che definisce un cristallo; la cui cellula unitaria corrisponde a un sistema cristallino di tipo ortorrombico.
Sintesi
Inizialmente è stato sintetizzato da composti naturali come derivati del corno animale, resine naturali, tra gli altri. A partire dal 1841, il fenolo è stato usato come precursore dell'acido picric, seguendo diverse rotte o attraverso diverse procedure chimiche.
Come già detto, è uno dei fenoli più acidi. Per sintetizzarlo è per primo richiesto che il fenolo subisca un processo di solfonazione, seguito da una procedura di nitrazione.
La solfonazione del fenolo anidro viene eseguita nel trattamento del fenolo con acido solforico di fumo, che si verificano sostituzioni elettrofili aromatiche di H da parte dei gruppi di solfonati, quindi3H, nella posizione -oto e -para rispetto al gruppo OH.
Questo prodotto, acido 2,4-pynoldisolfonico, viene eseguito il processo di nitrazione, trattandolo con acido nitrico concentrato. In tal modo, i due gruppi SO3H sono sostituiti da gruppi nitro, no2, E un terzo entra nell'altra posizione nitro. La seguente equazione chimica illustra questo:
Può servirti: materiali elastici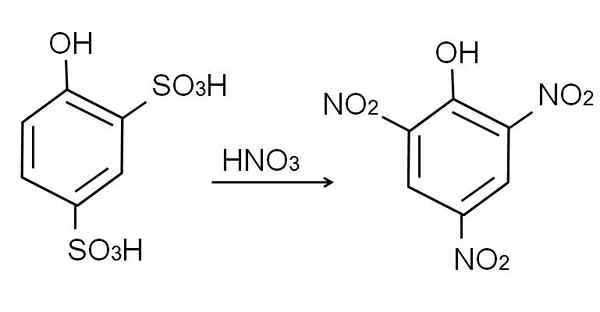 Nitra acida 2,4-fenoldisulfonica. Fonte: Gabriel Bolívar.
Nitra acida 2,4-fenoldisulfonica. Fonte: Gabriel Bolívar. Nitrazione diretta del fenolo
Il processo di nitrazione del fenolo non può essere eseguito direttamente, poiché vengono generati bersagli ad alto peso molecolare. Questo metodo di sintesi richiede un controllo molto attento della temperatura poiché è molto esotermico:
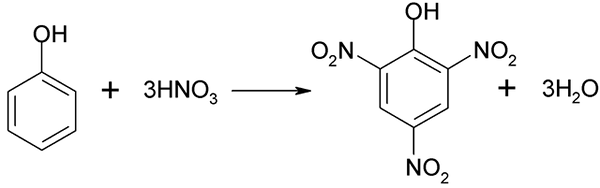 Nitrazione diretta del fenolo. Fonte: Akane700 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]
Nitrazione diretta del fenolo. Fonte: Akane700 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)] L'acido píchric può essere ottenuto quando si esegue il processo di nitrazione diretta di 2,4-dinitrofenolo, con acido nitrico.
Un'altra forma di sintesi è il trattamento del benzene con acido nitrico e nitrato mercurico.
Proprietà fisiche e chimiche
Peso molecolare
229.104 g/mol.
Aspetto fisico
Massa gialla di cristalli bagnati.
Odore
È un bagno.
Gusto
È molto amaro.
Punto di fusione
122.5 ° C.
Punto di ebollizione
300 ° C. Ma, quando si scioglie, esplode.
Densità
1,77 g/ml.
Solubilità
È un composto solubile in acqua moderatamente. Questo perché i tuoi gruppi OH e no2 Possono interagire con molecole d'acqua con ponti idrogeno; Sebbene l'anello aromatico sia idrofobico, ed è per questo che danneggia la sua solubilità.
Corrosività
L'acido pycric è corrosivo in generale per i metalli, ad eccezione di stagno e alluminio.
PKA
0.38. È un forte acido organico.
Instabilità
L'acido píchric è caratterizzato dal possesso di proprietà instabili. Costituisce un rischio per l'ambiente, è instabile, esplosivo e tossico.
Deve essere conservato ben chiuso per evitare la disidratazione, poiché l'acido picrico è molto esplosivo se è permesso asciugare. Devi stare molto attento con la sua forma anidra, perché è molto sensibile all'attrito, ai colpi e al calore.
L'acido pichrale deve essere conservato in siti ventilati e freschi, tutt'altro che materiali ossidabili. È irritante contattare con la pelle e le mucose, non dovrebbe essere ingerito ed è tossico per il corpo.
Applicazioni
L'acido píchric è stato ampiamente utilizzato nell'area di ricerca, in chimica, nell'industria e nel campo militare.
Indagine
Se usato come fissativo di cellule e tessuti, migliora i risultati del colore con coloranti acidi. Succede con metodi di colorazione tricromica. Dopo aver impostato il tessuto con formalina, si raccomanda una nuova fissazione con acido píchric.
Può servirti: premi filtro: caratteristiche, parti, come funziona, usiIn questo modo è garantita una colorazione intensa e molto brillante dei tessuti. I buoni risultati sono ottenuti con i coloranti di base. Tuttavia, le precauzioni devono.
Chimica organica
-In chimica organica viene utilizzato come alcalina picrate per fare l'identificazione e l'analisi di varie sostanze.
-Viene utilizzato nella chimica analitica del metallo.
-Nei laboratori clinici viene utilizzato per determinare i livelli sierici e urinari di creatinina.
-È stato anche usato in alcuni dei reagenti utilizzati per l'analisi dei livelli di glucosio.
Nell'industria
-A livello dell'industria fotografica, l'acido píchric è stato usato come sensibilizzatore nelle emulsioni fotografiche. Ha fatto parte dell'elaborazione di prodotti come pesticidi, insetticidi forti, tra gli altri.
-L'acido píchric viene usato per sintetizzare altri composti chimici intermedi come la cloropicrina e l'acido picramico, per esempio. Da questi composti sono stati sviluppati alcuni farmaci e coloranti per l'industria della pelle.
-L'acido píchric è stato usato nel trattamento delle ustioni, come le condizioni antisettiche e altre condizioni, prima che la sua tossicità fosse evidenziata.
-Componente importante dalla sua natura esplosiva nell'elaborazione di partite e batterie.
Applicazioni militari
-A causa dell'elevata esplosività dell'acido píchric, è stato usato nelle piante di munizioni di armi militari.
-È stato utilizzato l'acido píchric pressato e lanciato in proiettili di artiglieria, pompe e miniere.
-Il sale di ammonio acido picrico è stato usato come esplosivo, è molto potente ma meno stabilità di TNT. Per un po 'è stato usato come componente del carburante a razzo.
Tossicità
È stato dimostrato che è molto tossico per l'organismo umano e in generale per tutti gli esseri viventi.
Si raccomanda di evitare la sua inalazione e ingestione, per avere una tossicità orale acuta. Causa anche la mutazione nei microrganismi. Presenta effetti tossici sulla fauna selvatica, nei mammiferi e in generale nell'ambiente.
Riferimenti
- Carey f. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Università di Purdue. (2004). Esplosione di acido picric. Estratto da: Cheded.Chimica.Purdue.Edu
- « Patricia Benner Biografia, teoria e altri contributi
- Maguey cosa è, caratteristiche, habitat, riproduzione »

