Acido nitrico (HNO3)
- 3235
- 364
- Benedetta Rinaldi
Lui acido nitrico È un composto inorganico che consiste in un oxoacide di azoto. È considerato un forte acido, sebbene il suo PKA (-1,4) sia simile al PKA dello ione idronio (-1,74). Da questo punto, è forse il "più debole" di molti acidi forti noti.
Il suo aspetto fisico è costituito da un liquido incolore che mediante conservazione cambia a un colore giallastro, a causa della formazione di gas di azoto. La sua formula chimica è HNO3.
È instabile, sperimentando una leggera decomposizione per l'esposizione alla luce solare. Inoltre, può essere completamente scomposto riscaldando, causando azoto, acqua e biossido di ossigeno.
Viene utilizzato nella produzione di nitrati inorganici e organici, nonché in composti nitrosi che vengono utilizzati nella produzione di fertilizzanti, esplosivi, intermediari di coloranti e diversi composti chimici organici.
Nell'atmosfera, no2 prodotto dall'attività umana reagisce con l'acqua delle nuvole, formando HNO3. Quindi, durante le piogge acide, precipita insieme alle gocce d'acqua che mangiano, ad esempio le statue dei quadrati pubblici.
L'acido nitrico è un composto molto tossico e l'esposizione continua ai suoi vapori può produrre bronchite cronica e polmonite chimica.
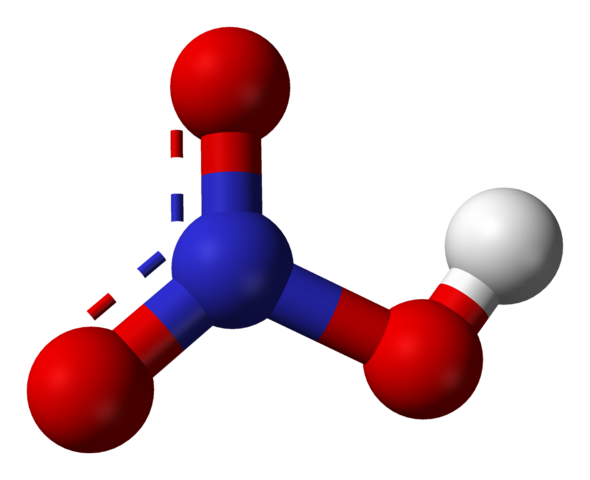
Struttura dell'acido nitrico
 Fonte: Ben Mills [dominio pubblico], di Wikimedia Commons
Fonte: Ben Mills [dominio pubblico], di Wikimedia Commons L'immagine superiore mostra la struttura di una molecola HNO3 Con un modello di sfere e barre. L'atomo di azoto, la sfera blu, si trova al centro, circondato da una geometria piatta trigonale; Tuttavia, il triangolo è distorto da uno dei suoi vertici più lunghi.
Le molecole di acido nitrico sono quindi piatti. I collegamenti N = O, N-O e N-OH costituiscono i vertici del triangolo piatto. Se osservato in dettaglio, il collegamento N-OH è più allungato degli altri due (dove la sfera bianca rappresenta l'atomo H).
Strutture di risonanza
Ci sono due collegamenti che hanno la stessa lunghezza: n = o e n-o. Questo fatto va contro la teoria dei collegamenti di Valencia, dove si prevede che i doppi collegamenti sono più brevi dei collegamenti semplici. La spiegazione in questo risiede nel fenomeno della risonanza, come osservato nell'immagine inferiore.
 Fonte: Ben Mills [dominio pubblico], di Wikimedia Commons
Fonte: Ben Mills [dominio pubblico], di Wikimedia Commons Entrambi i collegamenti, N = O e N-O, sono quindi equivalenti in termini di risonanza. Questo è rappresentato graficamente nel modello di struttura usando una linea discontinua tra due atomi di O (vedi struttura).
Quando l'HNO non è protetto3, L'anione di nitrato stabile è formato no3-. In esso, la risonanza ora coinvolge i tre atomi di O. Questo è il motivo per cui l'HNO3 Ha una grande acidità di lowry bronsted (specie di donatore Hone+).
Può servirti: pipetta aforataProprietà fisiche e chimiche
Nomi chimici
-Acido nitrico
-Acido azotico
-Nitrato di idrogeno
-Fortis Water.
Peso molecolare
63.012 g/mol.
Aspetto fisico
Liquido incolore o un colore giallo pallido, che può diventare marrone rossastro.
Odore
Acro, caratteristico soffocante.
Punto di ebollizione
181 ºF a 760 mmHg (83 ºC).
Punto di fusione
-41,6 ºC.
Solubilità dell'acqua
Molto solubile e miscibile con acqua.
Densità
1.513 g/cm3 a 20 ºC.
Densità relativa
1.50 (in relazione all'acqua = 1).
Densità del vapore relativa
2 o 3 volte stimato (nella relazione aerea = 1).
Pressione del vapore
63,1 mmHg a 25 ºC.
Decomposizione
Per esposizione all'umidità atmosferica o di calore può decomporsi per il perossido di azoto. Quando questa decomposizione viene riscaldata, emette un fumo molto tossico da ossido di azoto e nitrato di idrogeno.
L'acido nitrico non è stabile, essendo in grado di entrare in contatto con calore e esposizione alla luce solare e emettere biossido di azoto, ossigeno e acqua.
Sostanza vischiosa
1.092 MPa a 0 ºC e 0,617 MPa a 40 ° C.
Corrosione
È in grado di attaccare tutti i metalli di base, tranne l'alluminio e l'acciaio cromico. Attacca alcune delle varietà di materiale plastico, gomme e rivestimenti. È una sostanza caustica e corrosiva, quindi deve essere manipolata con alta cautela.
Entalpia molare della vaporizzazione
39,1 kJ/mol a 25 ºC.
Entalpia molare standard
-207 kJ/mol (298 ºF).
Entropia molare standard
146 kJ/mol (298 ºF).
Tensione superficiale
-0,04356 n/m a 0 ºC
-0,04115 n/m a 20 ºC
-0,0376 n/m a 40 ºC
Soglia di odore
-Basso odore: 0,75 mg/m3
-Alto odore: 250 mg/m3
-Concentrazione irritante: 155 mg/m3.
Costante di dissociazione
PKA = -1,38.
Indice di rifrazione (η/d)
1.393 (16,5 ºC).
Reazioni chimiche
Idratazione
Può formare idrati solidi, come HNO3∙ h2O e hno3∙ 3h2O: "ghiaccio nitrico".
Dissociazione in acqua
L'acido nitrico è un forte acido che viene rapidamente ionizzato in acqua nel modo seguente:
Hno3 (L) +H2O (l) => h3O+ (AC) +NO3-
Formazione delle vendite
Reagisce con ossidi di base che formano nitrati e sale d'acqua.
Cao (S) +2 HNO3 (l) => ca (no3)2 (AC) +H2O (l)
Allo stesso modo, reagisce con le basi (idrossidi), formando un nitrato e un sale d'acqua.
NaOH (AC) +HNO3 (l) => nano3 (AC) +H2O (l)
E anche con carbonati e carbonati acidi (bicarbonati), formando anche l'anidride carbonica.
N / a2Co3 (AC)+HNO3 (l) => nano3 (AC)+H2O (l)+co2 (G)
Protonazione
L'acido nitrico può anche comportarsi come una base. Per questo motivo, puoi reagire con l'acido solforico.
Hno3 + 2h2SW4 NO2+ + H3O+ + 2HSO4-
Auto -processo
L'acido nitrico sperimenta un'auto -proporzione.
2hno3 NO2+ + NO3- + H2O
Ossidazione dei metalli
Nella reazione con i metalli, l'acido nitrico non si comporta come acidi forti, che reagiscono con i metalli che formano il sale corrispondente e rilasciano idrogeno in modo gassoso.
Può servirti: idrocolideTuttavia, il magnesio e il manganese reagiscono caldi con l'acido nitrico, come fanno i rimanenti acidi forti.
Mg (s) +2 HNO3 (l) => mg (no3)2 (AC) +H2 (G)
Altri
L'acido nitrico reagisce con solfiti metallici che causano sale di nitrato, biossido di zolfo e acqua.
N / a2SW3 (S) +2 HNO3 (L) => 2 nano3 (AC) +SO2 (g) +H2O (l)
E reagisce anche con composti organici, sostituendo un idrogeno con un gruppo nitro; Costituendo così la base per la sintesi di composti esplosivi come nitroglicerina e trinitrotoluene (TNT).
Sintesi
Industriale
È prodotto a livello industriale attraverso l'ossidazione catalitica dell'ammonio, secondo il metodo descritto da Oswald nel 1901. La procedura consiste in tre fasi o passaggi.
Fase 1: ossidazione dell'ossido di ossido nitrico
L'ammonio viene ossidato dall'ossigeno presente nell'aria. La reazione è fatta a 800 ºC e un 6-7 atm, con l'uso del platino come catalizzatore. L'ammonio è miscelato con l'aria con la seguente proporzione: 1 volume di ammonio per 8 volumi d'aria.
4nh3 (g) +5o2 (g) => 4no (g) +6h2O (l)
Nella reazione ha origine l'ossido nitrico, che viene portato nella camera di ossidazione per la fase successiva.
Fase 2. Ossidazione dell'ossido nitrico nel biossido di azoto
L'ossidazione viene eseguita dall'ossigeno presente nell'aria a una temperatura inferiore a 100 ºC.
2no (g) +o2 (g) => 2no2 (G)
Fase 3. Dissoluzione del biossido di azoto in acqua
In questa fase, si verifica la formazione di acido nitrico.
42 + 2h2O +o2 => 4hno3
Esistono diversi metodi per l'assorbimento di biossido di azoto (no2) In acqua.
Tra gli altri metodi: no2 è dimenizzato a n2O4 a basse temperature e alta pressione, al fine di aumentare la solubilità dell'acqua e produrre acido nitrico.
3n2O4 + 2h2O => 4hno3 + 2
L'acido nitrico prodotto dall'ossidazione dell'ammonio ha una concentrazione tra il 50-70%, che può essere preso al 98% usando l'acido solforico concentrato come disidratante, consentendo di aumentare la concentrazione di acido nitrico.
In laboratorio
Decomposizione termica del nitrato di rame (II), producendo gas di biossido di azoto e ossigeno, che vengono passati attraverso l'acqua per formare acido nitrico; Come nel metodo Oswald, precedentemente descritto.
2CU (n3)2 => 2cuo +4no2 + O2
Reazione di un sale di nitrato con h2SW4 concentrato. L'acido nitrico formato è separato da H2SW4 per distillazione a 83 ºC (punto di ebollizione dell'acido nitrico).
Può servirti: pipetta graduata: caratteristiche e usiKno3 + H2SW4 => Hno3 + KHSO4
Applicazioni
- Il 60% della produzione di acido nitrico viene utilizzato nella produzione di fertilizzanti, in particolare nitrato di ammonio.
- Il 15 % della produzione di acido nitrico viene utilizzato nella produzione di fibre sintetiche.
- È usato in elaborazione di esteri acidi nitrici e nitroderivati; come nitrocellulosa, dipinti acrilici, nitrobenzene, nitrotoluene, acrilonitrilos, ecc.
- Puoi aggiungere gruppi nitro ai composti organici, essendo in grado di utilizzare questa proprietà per produrre esplosivi come nitroglicerina e trinitrotoluene (TNT).
- A causa della sua capacità ossidante, è molto utile nella purificazione dei metalli presenti nei minerali. Viene anche usato per ottenere elementi come uranio, manganese, niobio, zirconio e nell'acidificazione delle rocce fosforiche per ottenere acido fosforico.
- È miscelato con acido cloridrico concentrato per formare "acqua reale". Questa soluzione è in grado di dissolvere oro e platino, il che consente il suo uso nella purificazione di questi metalli.
- Viene utilizzato per ottenere un effetto di anzianità sui mobili realizzati con legno di pino. Il trattamento con una soluzione di acido nitrico al 10% produce un colore gold-oro nel legno di mobili.
- La miscela di soluzioni acquose di 5-30% di acido nitrico e acido fosforico 15-40% viene utilizzata per pulire l'attrezzatura utilizzata nel lavoro di mungitura, al fine di eliminare i rifiuti dai precipitati di magnesio e composti di calcio.
- È utile per pulire il materiale di vetro utilizzato in laboratorio.
- A causa della sua capacità di solvente, viene utilizzato nell'analisi di diversi metalli attraverso le tecniche di spettrofotometria di assorbimento della fiamma atomica e la spettrofotometria della massa di accoppiamento induttivo.
- La combinazione di acido nitrico e acido solforico è stata utilizzata per la conversione di cotone comune in nitrato di cellulosa (cotone nitrico).
- Acido nitrico di fumo rosso e acido nitrico fumo bianco, sono usati come ossidanti per i carburanti liquidi, specialmente nel missile Bomarc.
Tossicità
- A contatto con la pelle può causare ustioni della pelle, dolore intenso e dermatite.
- In contatto con gli occhi può causare intenso, strappo e nei casi gravi, danni della cornea e della cecità.
- L'inalazione dei vapori può causare tosse, angoscia respiratoria, causando esibizioni intense o croniche, sanguinamento del naso, lingingite, bronchite cronica, polmonite ed edema polmonare.
- A causa della sua ingestione, si verificano lesioni in bocca, salivazione, sete intensa, dolore ingoiato, dolore intenso all'intero tratto digestivo e al rischio di perforazione del muro dello stesso.
Riferimenti
- Acido nitrico. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov
- Acido nitrico. Encyclopædia Britannica. Recuperato da: Britannica.com
- Acido nitrico. Recuperato da: chimico.com
- « Idee che affrontano il pensiero teologico con la teoria evolutiva
- Come erano le elezioni in cui non c'era un sistema elettorale autonomo e affidabile? »

