Acido iposulfuro
- 4314
- 736
- Cosetta Messina
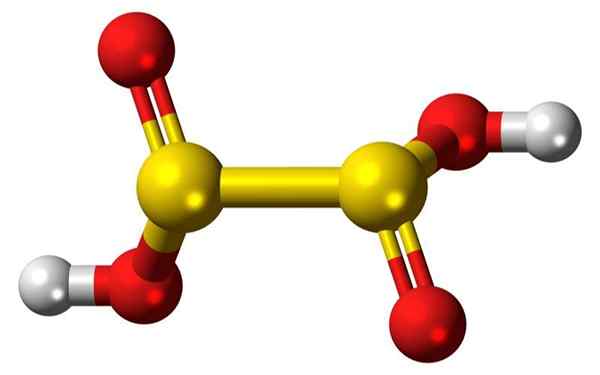
 Barra 3d di bar e palloncini di una molecola di acido iposulfuro. Fonte: Jynto
Barra 3d di bar e palloncini di una molecola di acido iposulfuro. Fonte: Jynto Cos'è l'acido iposulfuro?
Lui Acido iposulfuro, o acido dionico, è sconosciuto, instabile puramente, non ha esistenza indipendente e non è stato rilevato in soluzione acquosa.
Teoricamente, sarebbe un acido relativamente debole, paragonabile all'acido zolfo, H2SO3. Sono noti solo i loro sali, i dionito, che sono stabili e sono potenti agenti riducenti. Il sale di acido dionico di sodio è del sodio dionito.
Formule
Le formule di acido iposulfuro sono le seguenti:
Acido dionico: h2S2O4
Dionito anion: s2o42−
Sodio dionitolo: NA2S2O4
Numero CAS: 20196-46-7 Acido iposulfuro (o Dital)
Numero CAS: 14844-07-6 Acido iposulfuro (o Dizione, ione)
Numero CAS: 7775-14-6 Dionitolo di sodio (sodio di sodio di acido da dedito
Proprietà fisiche e chimiche
- Nel sale del dionito di sodio, il suo aspetto è una polvere cristallina, bianca a grigiastra, con scaglie di limone leggera e debole di zolfo.
- Il peso molecolare dell'acido di ditazione è 130.132 g/mol. L'anione Dionito, 128.116 g/mol e il dionito di sodio, 174.096 g/mol.
- Nel punto di ebollizione del dionito di sodio, si decompone e il suo punto di fusione è 52 ° C.
- La densità del dionito di sodio è 2.38 g/cm³ (anidro) e la sua solubilità in acqua è 18.2 g/100 ml (anidro, 20 ° C).
- L'acido iposulfuro è un oxoacido di zolfo con la formula chimica H2S2O4.
- Gli oxoacidi di zolfo sono composti chimici che contengono zolfo, ossigeno e idrogeno. Tuttavia, alcuni di essi sono noti solo per i loro sali (come acido iposulfuro, acido dizione, acido disolfuro e acido zolfo).
Può servirti: piridina: struttura, proprietà, usi, tossicità, sintesiTra le caratteristiche strutturali degli oxoacidi che abbiamo:
- Zolfo tetraedrico quando è coordinato con ossigeno.
- Atomi di ossigeno nel ponte e nel terminale.
- Gruppi periodinali.
- Terminali s = s.
- Catene di (-s-) n
L'acido solforico è il più noto ossoacido di zolfo.
- L'anione Dionito ([s2O4] 2-) è un oxoanione (uno ione con la formula generica axoy z-) di zolfo derivato formalmente dall'acido dicicico.
- Gli ioni dionito sperimentano idrolisi acida e alcalina a tiosolfato e bisolfito, solfito e solfuro.
- Il sale acido dionico di sodio è dionite di sodio (noto anche come idrosolfito di sodio).
- Può essere ottenuto dal bisolfito di sodio attraverso la seguente reazione:
2 Nahso3 + Zn → Na2SW4 + Zn (oh) ²
Applicazioni
Lo ione dionite viene spesso usato in combinazione con un agente complesso (ad esempio acido citrico), per ridurre il ferro-idrossido di ossi (III) nei composti di ferro solubile (II) ed eliminare le fasi minerali amorfe che contengono ferro (III) Analisi (estrazione selettiva).
Dioniito consente di aumentare la solubilità del ferro. Grazie alla forte affinità dello ione Dionito per cationi metallici bivalenti e trivalenti, è usato come agente chelante.
La decomposizione di Dioniito produce specie di zolfo ridotte che possono essere molto aggressive per la corrosione dell'acciaio e dell'acciaio inossidabile.
Tra le applicazioni del dionito di sodio abbiamo:
Nell'industria
- Questo composto è un sale solubile in acqua e può essere usato come agente riducente nelle soluzioni acquose.
- È usato come tale in alcuni processi di colorante industriale, principalmente quelli che coinvolgono coloranti di zolfo e coloranti della vasca, in cui un colorante insolubile in acqua può essere ridotto a un sale metallico alcalino solubile in acqua (ad esempio, il colorante indaco).
Può servirti: acidi: caratteristiche ed esempi- Le proprietà di riduzione del dionito di sodio eliminano anche coloranti in eccesso, ossido residuo e pigmenti indesiderati, migliorando così la qualità globale del colore.
- Il dioniito del sodio può essere utilizzato anche per il trattamento delle acque, la purificazione del gas, la pulizia ed estrazione. Può anche essere utilizzato in processi industriali come un agente solfonante o una fonte di sodio.
- Oltre all'industria tessile, questo composto viene utilizzato in industrie correlate in pelle, cibo, polimeri, fotografia e molti altri. Viene anche usato come agente decolorante nelle reazioni organiche.
In scienze biologiche
- Il dioniito del sodio è spesso utilizzato negli esperimenti di fisiologia come mezzo per ridurre il potenziale redox delle soluzioni.
Nelle scienze geologiche
- Il dioniito del sodio è spesso utilizzato negli esperimenti di chimica del suolo per determinare la quantità di ferro che non è incorporata nei minerali di silicato primario.
Sicurezza e rischi
La manipolazione di questo elemento deve essere eseguita in condizioni di cura estrema. È estremamente tossico e può reagire pericolosamente in combinazione con acqua e aria.
Successivamente, mettiamo in evidenza alcuni aspetti.
Reazioni di aria e acqua
- Il dionito di sodio è un combustibile solido che si decompone lentamente quando è in contatto con l'acqua o il vapore acqueo, formando tiosolfati e bisolfiti.
- Questa reazione produce calore, che può accelerare ulteriormente la reazione o far bruciare i materiali circostanti. Se la miscela è limitata, la reazione di decomposizione può comportare la pressurizzazione del contenitore, che può essere rotto fortemente. Quando rimane in aria, si ossida lentamente, generando gas di biossido di zolfo tossico.
Può servirti: nitrofurans: caratteristiche, meccanismo d'azione e classificazionePericolo di incendio
- Il dionito di sodio è un materiale infiammabile e combustibile. Può essere infiammato a contatto con aria bagnata o umidità. Puoi bruciare rapidamente con effetto del bagliore. Può reagire vigorosamente o esplosivamente a contatto con l'acqua.
- Può essere suddiviso in modo esplosivo quando riscaldato o è coinvolto in un incendio. Può accendere di nuovo dopo che l'incendio è stato estinto. Il deflusso può creare pericolo di incendio o esplosione. I contenitori possono esplodere quando riscaldati.
Pericolo di salute
- Dopo essere entrato in contatto con il fuoco, il dionito di sodio produrrà gas irritanti, corrosivi e/o tossici. L'inalazione di prodotti di decomposizione può causare gravi lesioni o morte. Il contatto con la sostanza può causare gravi ustioni sulla pelle e gli occhi. Il deflusso del controllo del fuoco può causare contaminazione.
Riferimenti
- Benjah-BMM27 (2006). Un modello a palla e stick dell'ione di ditionite [immagine] recuperato da.Wikipedia.org.
- Mills, b. (2009). Sodio-ditionite -xtal-1992-3d-Balls [immagine] recuperato da: in.Wikipedia.org.

