Acido formico (hcooh)
- 667
- 71
- Kayla Serr
Spieghiamo cos'è l'acido formico, le sue proprietà, la struttura e le applicazioni
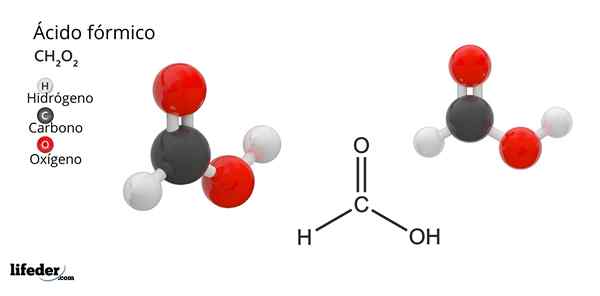
 Formula e struttura dell'acido formico
Formula e struttura dell'acido formico Cos'è l'acido formico?
Lui acido formico o acido metanoÈ il composto più semplice e piccolo di tutti gli acidi organici. È anche noto come acido metano e la sua formula molecolare è hcooh, con solo un atomo di idrogeno legato all'atomo di carbonio. Il suo nome deriva dalla parola formica, che in latino significa formica.
I naturalisti del XV secolo scoprirono che alcuni tipi di insetti (i formícidos), come formiche, termiti, api e coleotteri, secernono questo composto responsabile del loro doloroso tritato. Inoltre, questi insetti usano l'acido formico come meccanismo per attacchi, difesa e segnaletica chimica.
Hanno ghiandole velenose che esprimono questo e altri acidi (ad esempio, acido acetico) come una rugiada all'esterno. L'acido formico è più forte dell'acido acetico (CH3Cooh); Pertanto, disciolto in quantità uguali in acqua, l'acido formico produce soluzioni con valori di pH più bassi.
Il naturalista inglese John Ray raggiunse l'isolamento dell'acido formico nel 1671, distollandolo da grandi quantità di formiche.
D'altra parte, la prima sintesi di successo di questo composto è stata eseguita dal chimico e fisico francese Joseph Gay-Lussac, usando l'acido notturno (HCN) come reagente.
Dov'è l'acido formico?
 Le formiche secernono acido formico
Le formiche secernono acido formico L'acido formico può essere presente a livelli terrestri, come componente della biomassa o nell'atmosfera, coinvolto in un ampio spettro di reazioni chimiche; Può anche essere trovato sotto i terreni, all'interno del petrolio o in una fase gassosa sulla sua superficie.
In termini di biomassa, insetti e piante sono i principali generatori di questo acido. Quando i combustibili fossili vengono bruciati producono acido formico gassoso; Di conseguenza, i motori del veicolo rilasciano acido formico nell'atmosfera.
Tuttavia, la Terra ospita un numero esorbitante di formiche e tra tutti questi sono in grado di produrre in un anno migliaia di volte la quantità di acido formico generato dall'industria umana. Inoltre, gli incendi boschivi rappresentano fonti gassose di acido formico.
Può servirti: litio: storia, struttura, proprietà, rischi e usiSopra, nella complessa matrice atmosferica, si verificano processi fotochimici che sintetizzano l'acido formico.
A questo punto, molti composti organici volatili (COV) sono degradati sotto gli effetti delle radiazioni ultraviolette o sono ossidati da meccanismi radicali liberi OH. La chimica atmosferica ricca e complessa è di gran lunga la fonte predominante di acido formico formale.
Struttura dell'acido formico
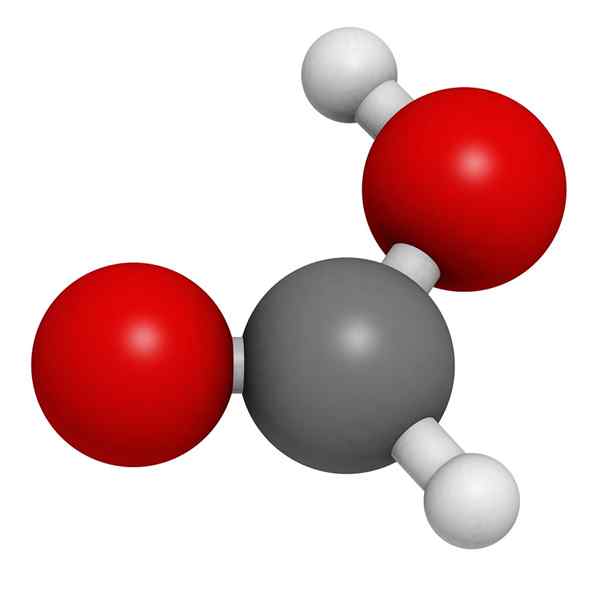 Modello molecolare di acido formico
Modello molecolare di acido formico Nell'immagine superiore, è illustrata la struttura di una fase gassosa dell'acido formico. Le sfere bianche corrispondono ad atomi di idrogeno, ossigeno rosso e atomi neri agli atomi di carbonio.
In queste molecole possono essere apprezzati due gruppi: idrossile (-oh) e formil (-ch = o), entrambi in grado di formare ponti idrogeno.
Queste interazioni sono di tipo O-H-O, essendo gli idrossili raggruppano i donatori dell'H e i gruppi formano i donatori di OR.
Tuttavia, h collegato all'atomo di carbonio manca di questa capacità. Queste interazioni sono molto forti e, a causa dell'atomo di H poveri negli elettroni, l'idrogeno del gruppo OH è più acido; Pertanto, questo idrogeno stabilizza ulteriormente i ponti.
Come risultato di quanto precede, l'acido formico esiste in forma di bullone e non come una singola molecola.
Struttura cristallina
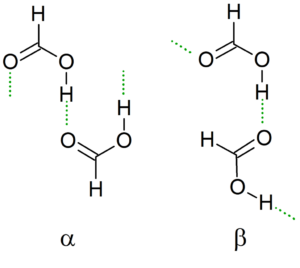
Mentre la temperatura scende, il dimero guida i suoi ponti idrogeno per generare la struttura più stabile possibile insieme agli altri dimeri, creando così le catene infinite α e β di acido formico.
Un'altra nomenclatura sono i conformatori "cis" e "trans". In questo caso, "CIS" viene utilizzato per designare gruppi orientati nella stessa direzione e "trans" per quei gruppi in contrasto.
Può servirti: equilibrio tanteo: passaggi, esempi ed eserciziAd esempio, nella catena α i gruppi formato "punto" allo stesso lato (a sinistra), in contrasto con la catena β, in cui questi gruppi formilici indicano i lati opposti (immagine superiore).
Questa struttura cristallina dipende dalle variabili fisiche che agiscono su di essa, come la pressione e la temperatura. Pertanto, le catene sono convertibili; Cioè, in condizioni diverse una catena "cis" può essere trasformata in una catena "trans" e viceversa.
Se le pressioni aumentano a livelli drastici, le catene sono abbastanza compresse da essere considerate un polimero cristallino di acido formico.
Proprietà dell'acido formico
Le proprietà fisiche e chimiche dell'acido formico sono menzionate di seguito:
- L'acido formico è un liquido a temperatura ambiente, incolore e con un odore forte e penetrante. Ha un peso molecolare di 46 g/mol, si scioglie a 8,4 ° C e ha un punto di ebollizione di 100,8 ºC, maggiore di quello dell'acqua.
- È miscibile in acqua e solventi organici polari, come etere, acetone, metanolo ed etanolo.
- D'altra parte, nei solventi aromatici (come benzene e toluene) è leggermente solubile, perché l'acido formico ha a malapena un atomo di carbonio nella sua struttura.
- Ha un PKA di 3,77, più acido di quello dell'acido acetico, che può essere spiegato perché il gruppo metilico fornisce densità elettronica all'atomo di carbonio ossidato dai due ossigeno. Ciò si traduce in una leggera discesa nell'acidità del protone (CH3COOH, HCOOH).
- Insabbiato l'acido, questo diventa il formato anione hcoo-, che può demociare il carico negativo tra i due atomi di ossigeno. Pertanto, è un anione stabile e spiega la grande acidità dell'acido formico.
Reazioni
L'acido formico può essere disidratato nel monossido di carbonio (CO) e nell'acqua. In presenza di catalizzatori di platino, può anche decomporre nell'idrogeno molecolare e nell'anidride carbonica:
HCOOH (L) → H2(g) + co2(G)
Questa proprietà consente di essere considerato l'acido formico un modo sicuro per conservare l'idrogeno.
Usi/applicazioni di acido formico
L'industria alimentare e agricola
Nonostante quanto possa essere dannoso l'acido formico, viene utilizzato a concentrazioni adeguate come conservante negli alimenti a causa della sua azione antibatterica. Per lo stesso motivo viene utilizzato in agricoltura, dove ha anche un'azione di pesticidi.
Presenta anche un'azione conservativa sui pascoli, che aiuta a prevenire i gas intestinali negli animali riproduttori.
Il settore tessile e calzature
È usato nell'industria tessile nella colorazione e nel raffinamento dei tessuti, forse l'uso più frequente di questo acido essere.
L'acido formico viene utilizzato nella lavorazione della pelle grazie alla sua miserazione e nell'eliminazione dei capelli di questo materiale.
Sicurezza stradale sulle strade
Oltre agli usi industriali indicati, quelli derivati dall'acido del formato (formati) vengono utilizzati in Svizzera e Austria sulle strade durante l'inverno, al fine di ridurre il rischio di incidenti. Questo trattamento è più efficiente dell'uso di sale comune.
Riferimenti
- Tellus (1988). Formico atmosferico dalle formiche di formicina: una valutazione preliminare408, 335-339.
- B. Millet et al. (2015). Fonti e lavandini dell'acido formico atmosferico. Atmos. Chimica. Phys., 15, 6283-6304.
- Wikipedia. (2018). ACIDO FORMICO. Recuperato da.Wikipedia.org
- Attivo. ACIDO FORMICO. Recuperato da Actipedia.org
- Dottore. N. K. Patel. MODURE: 2, Conferenza: 7. ACIDO FORMICO. Nptel si è ripreso.AC.In
- Jean e Fred. (14 giugno 2017). Lasciando i tumuli termiti. [Figura]. Recuperato da: Flickr.com

