Acido fluororico (HF)
- 3138
- 954
- Kayla Serr
Cos'è l'acido fluororico?
Lui acido fluoridrico (HF)È una soluzione acquosa in cui viene sciolto il fluoruro di idrogeno. Questo acido si ottiene principalmente dalla reazione di acido solforico concentrato con minerale di fluoriti (CAF2). Il minerale è degradato dall'azione dell'acido e dell'acqua rimanenti dissolve i gas di fluoruro di idrogeno.
Da questa stessa acqua acida, il prodotto puro può essere distillato, cioè anidride idrogeno fluoruro. A seconda delle quantità di gas disciolto, si ottengono diverse concentrazioni e, quindi, diversi prodotti disponibili di acido fluorrotto nel mercato.
Ad una concentrazione inferiore al 40 %, ha un aspetto cristallino indistinguibile di acqua, ma a concentrazioni più elevate si dice addio ai vapori di fluoro di idrogeno bianco idrogeno. L'acido fluororico è noto come uno dei prodotti chimici più aggressivi e pericolosi.
È in grado di "mangiare" quasi tutti i materiali con cui hai contatto: da vetro, ceramica e metalli, alle rocce e in cemento. In cui viene quindi memorizzato il contenitore? In bottiglie di plastica, polimeri sintetici inerti alla tua azione.
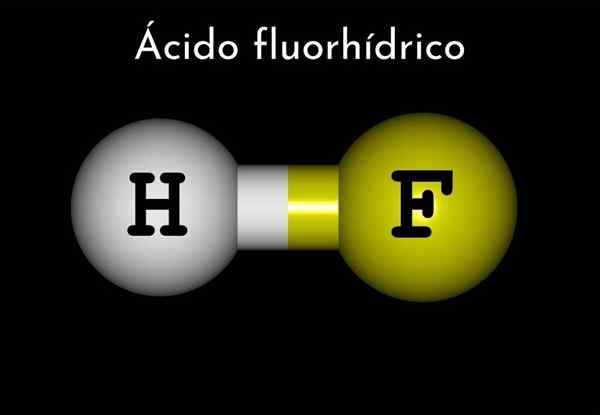
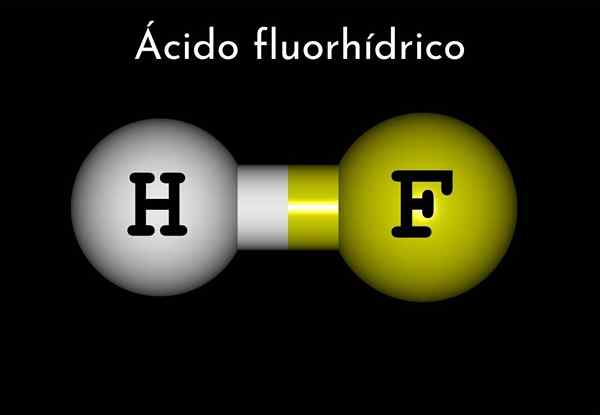
Formula
La formula del fluoruro di idrogeno è HF, ma quella dell'acido fluorico è rappresentata in un mezzo acquoso, HF (AC), per differenziarsi dal primo.
Pertanto, l'acido fluororico può essere considerato come idrogeno fluoruro di idrogeno, e questo è anidride.
Struttura di acido fluoridrico
 Modello 3D di acido fluoridico
Modello 3D di acido fluoridico Tutto l'acido in acqua ha la capacità di generare ioni in una reazione di equilibrio. Nel caso dell'acido fluoruro, si stima che in una soluzione esiste la coppia di hels h3O+ e f-.
Anione f- Probabilmente formano un ponte idrogeno molto forte con uno degli idrogeni catili (F-H-O+-H2). Questo spiega perché l'acido fluorohorico è un debole acido Bree (donatore di protoni, h+), nonostante la sua alta e pericolosa reattività; cioè, in acqua non rilascia così tanti h+ Rispetto ad altri acidi (HCl, HBr o HI).
Può servirti: quanti elettroni di custodia hanno il carbonio?Tuttavia, nelle interazioni concentrate di acido fluorhorico tra molecole di fluoro idrogeno sono abbastanza efficaci da consentire loro di sfuggire in una fase gassosa.
Cioè, all'interno dell'acqua possono interagire come se fossero nell'anidride liquida, formando così ponti idrogeno tra questi. Questi ponti idrogeno possono essere assimilati come catene quasi lineari (H-F-H-F-H-F- ...) circondate dall'acqua.

Nell'immagine superiore, la coppia non condivisa degli elettroni orientata nella direzione opposta del collegamento (H-F :) interagisce con un'altra molecola HF per assemblare la catena.
Proprietà di acido fluoridrico
Poiché è acido fluorhorico Una soluzione acquosa, le sue proprietà dipendono dalla concentrazione di anidride disciolta in acqua. L'HF è molto solubile in acqua ed è igroscopico, essendo in grado di produrre una varietà di soluzioni: da molto concentrato (fumo e con toni gialli) a molto diluito.
Man mano che la sua concentrazione diminuisce, HF (AC) adotta proprietà più simili all'acqua pura rispetto all'anidride. Tuttavia, i ponti idrogeno H-F-H sono più forti di quelli in acqua, h2OH, OH.
Entrambi coesistono in armonia nelle soluzioni, aumentando i punti di ebollizione (fino a 105 ° C). Allo stesso modo, le densità aumentano quando viene sciolta più hinhidrid. Del resto, tutte le soluzioni HF (AC) hanno odori forti e irritanti e sono incolori.
Reattività
Allora qual è il comportamento corrosivo dell'acido fluoro? La risposta è nel collegamento H-F e nella capacità dell'atomo di fluoro di formare collegamenti covalenti molto stabili.
Poiché il fluoro è un atomo molto piccolo ed elettronegativo, è un potente acido Lewis. Cioè, si separa dall'idrogeno per collegare le specie che offrono più elettroni a un basso costo energetico. Ad esempio, queste specie possono essere metalli, come il silicio presente nel vetro.
Può servirti: chimica nucleare: storia, campo di studio, aree, applicazioniSio2 + 4 hf → sif4(g) + 2 h2O
Sio2 + 6 HF → H2Sif6 + 2 h2O
Se l'energia di dissociazione del collegamento H-F è alta (574 kJ/mol), perché è rotta nelle reazioni? La risposta ha sfumature cinetiche, strutturali ed energetiche. In generale, meno reattivo è il prodotto risultante, più è favorita la sua formazione.
Cosa succede a F- in acqua? Nelle soluzioni concentrate di acido fluorico un'altra molecola HF può formare un ponte idrogeno con F- della coppia [H3O+F-".
Ciò si traduce nella generazione dello ione defluoride [FHF]-, che è straordinariamente acido. Ecco perché tutto il contatto fisico con questo è estremamente dannoso. La minima esposizione può innescare un'infinità di danni all'agenzia.
Esistono molti standard di sicurezza e protocolli per una gestione adeguata e quindi evitano potenziali incidenti a coloro che operano con questo acido.
Usi/applicazioni di acido fluorhorico
È un composto con numerose applicazioni nel settore, nella ricerca e nel lavoro dei consumatori:
- L'acido fluororico genera derivati organici coinvolti nel processo di purificazione dell'alluminio.
- È usato nella separazione degli isotopi di uranio, come nel caso dell'uranio hexafluororo (UF6). Viene anche utilizzato nell'estrazione, nella lavorazione e nella raffinazione di metalli, rocce e oli, anche per l'inibizione della crescita e della rimozione della muffa dello stampo.
- Le proprietà dell'acido corrosivo sono state utilizzate per scolpire e registrare cristalli, in particolare gelida, attraverso la tecnica di incisione.
- Viene utilizzato nella produzione di semiconduttori in silicone, con molteplici usi nello sviluppo di informatica e informatica, responsabile dello sviluppo umano.
- Viene utilizzato nel settore automobilistico come detergente, utilizzato come sm di vetro in ceramica.
- Oltre a servire come intermediario in alcune reazioni chimiche, l'acido fluorotto viene utilizzato in alcuni scambiatori di ioni coinvolti nella purificazione di metalli e sostanze più complessi.
- Partecipa alla lavorazione dell'olio e ai suoi derivati, che ha permesso l'ottenimento di solventi da utilizzare nella produzione di prodotti per la pulizia e l'eliminazione dei grassi.
- È usato nella generazione di agenti per il trattamento con impiallacciatura e superficie.
- I consumatori utilizzano numerosi prodotti in cui l'acido fluororico ha partecipato alla sua elaborazione; Ad esempio, alcuni necessari per la cura dell'auto, la pulizia di prodotti per mobili, componenti elettrici ed elettronici e carburanti, tra gli altri prodotti.
Riferimenti
- PUBCHEM. (2018). Acido fluoridrico. Estratto il 3 aprile 2018 da: pubchem.NCBI.Nlm.NIH.Gov.
- Kat Day. (16 aprile 2013). L'acido che mangia davvero attraverso tutto. Estratto il 3 aprile 2018 da: ChronicleFlask.com
- Wikipedia. (28 marzo 2018). Acido fluoridrico. Estratto il 3 aprile 2018 da: in.Wikipedia.org.
- SHIVER & ATKINS. (2008). Chimica inorganica. (quarta edizione., P. 129, 207-249, 349, 407). Mc Graw Hill.
- Acido fluoridrico. Musc. Università medica della Carolina del Sud. Estratto il 3 aprile 2018 da: AcademicDepartments.Musc.Edu