Struttura cicloesana, usi, conformazioni
- 1975
- 26
- Dante Morelli
Lui Cicloesano È un ciclo relativamente stabile con la formula molecolare C6H12. È un liquido incolore e infiammabile che ha un odore di solvente morbido, ma che può penetrare nelle impurità.
Ha una densità di 0,779 g/cm3; bollire a 80,7 ° C; e congela a 6,4 ° C. È considerato insolubile nell'acqua, poiché la sua solubilità può essere solo di 50 ppm (ca.) a temperatura ambiente. Tuttavia, è facilmente mescolato con alcol, etere, cloroformio, benzene e acetone.
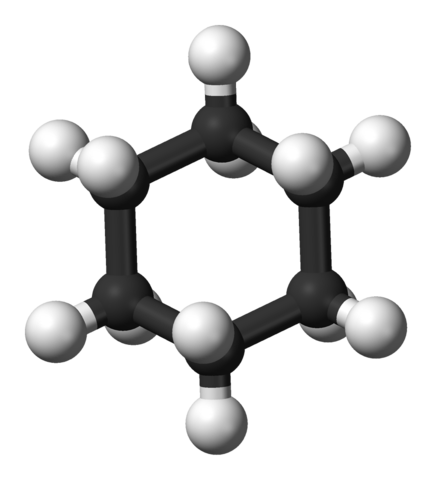
 Modello 3D della molecola di cicloesano. Jynte e Ben Mills / Dominio pubblico
Modello 3D della molecola di cicloesano. Jynte e Ben Mills / Dominio pubblico I sistemi ad anello cichaxan sono più comuni tra le molecole organiche della natura rispetto a quelle di altri cicloalcani. Ciò può essere dovuto sia alla loro stabilità che alla selettività offerta dalle sue conformazioni ben stabilite.
In effetti, carboidrati, steroidi, prodotti vegetali, pesticidi e molti altri composti importanti contengono anelli simili a quelli del cicloesano, le cui conformazioni sono di grande importanza per la loro reattività.
[TOC]
Struttura
Il cicloesano è un idrocarburo aliciclico di sei membri. Ci sono principalmente in una conformazione in cui tutti i legami C-H negli atomi di carbonio vicini sono sfalsati, con angoli diedri pari a 60 °.
Perché ha l'angolo e la tensione più bassi di torsione. Questo rende anche il cicloesano.
Posizioni dei sostituenti
Esistono due tipi di posizioni per i sostituenti nell'anello cicloesano: posizioni assiali e posizioni equatoriali. I collegamenti equatoriali C-H si trovano in una banda attorno all'Ecuador del ring.
A sua volta, ogni atomo di carbonio ha un idrogeno assiale che è perpendicolare al piano dell'anello e parallela al suo asse. Gli idrogeni assiali si alternano su e giù; Ogni atomo di carbonio ha una posizione assiale ed equatoriale; E ogni lato dell'anello ha tre posizioni assiali e tre equatoriali in una disposizione alternativa.
Può servirti: carbonato di sodio (Na2Co3)Modelli di studio
Cyclohexan sta studiando meglio un modello molecolare fisico o con un programma di modellazione molecolare. Quando uno di questi modelli viene utilizzato, è possibile osservare facilmente le relazioni di torsione e l'orientamento degli atomi di equatore e idrogeno assiale.
Tuttavia, la disposizione degli atomi di idrogeno può anche essere analizzata in una proiezione di Newman quando si osserva qualsiasi coppia di collegamenti C-C paralleli.
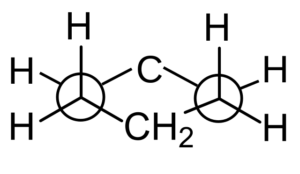 Proiezione di Newman da Cychaxan. Durfo / cc0
Proiezione di Newman da Cychaxan. Durfo / cc0 Conformazioni
Il cicloesano può verificarsi in due conformazioni interconvertibili: barca e sedia. Tuttavia, quest'ultima è la conformazione più stabile, poiché non vi è alcun angolo o tensione torsionale nella struttura del cicloesano; Più del 99% delle molecole è in una conformazione della sedia in qualsiasi momento.
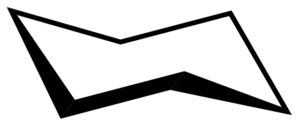 Conformazione della sedia cichaxan. CHEM SIM 2001 / Public Domain
Conformazione della sedia cichaxan. CHEM SIM 2001 / Public Domain Conformazione della sedia
In una conformazione della sedia, tutti gli angoli di collegamento C-C sono 109,5 °, che li rilascia dalla tensione angolare. Poiché i collegamenti C-C sono perfettamente scaglionati, la conformazione della sedia è anche priva di tensione torsionale. Inoltre, gli atomi di idrogeno negli angoli opposti dell'anello cicloesano sono separati al massimo.
Formazione della barca
La conformazione della sedia può assumere un'altra forma chiamata Formazione della barca. Ciò si verifica a seguito di rotazioni parziali su semplici legami C-C dell'anello. Anche tale conformazione non ha una tensione angolare, ma ha una tensione torsionale.
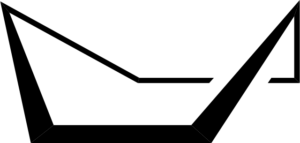 Conformazione della barca cicloesana. Keministi / dominio pubblico
Conformazione della barca cicloesana. Keministi / dominio pubblico Quando vedi un modello della conformazione della barca, negli assi di collegamento C-C lungo ciascun lato, si scopre che i legami C-H in quegli atomi di carbonio sono eclissi, producendo tensione torsionale.
Può servirti: derivati del benzeneInoltre, due degli atomi di idrogeno sono abbastanza vicini l'uno dall'altro per generare forze di repulsione di van der Waals.
Truffatore
Se la conformazione della barca è flessa, si ottiene la conformazione della barca storta che può alleviare parte della tensione torsionale e anche ridurre le interazioni tra gli atomi di idrogeno.
Tuttavia, la stabilità ottenuta dalla flessione è insufficiente per rendere la conformazione della barca storta più stabile della conformazione della sedia.
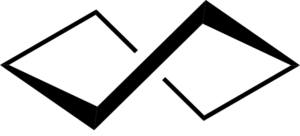 Ciclohexan Crooly Boat Conformation. Keministi / CC0
Ciclohexan Crooly Boat Conformation. Keministi / CC0 Applicazioni
Produzione in nylon
Quasi l'intero cicloesano che si verifica commercialmente (più del 98%) è ampiamente utilizzato come materia prima nella produzione industriale di precursori di nylon: acido adipico (60%), caprolattam ed esametilendiammina. Il 75% del caprolattam prodotto in tutto il mondo viene utilizzato per la produzione di nylon 6.
 Chitarra con corde di nylon. Fonte: Pexels.com
Chitarra con corde di nylon. Fonte: Pexels.com Fabbricazione di altri composti
Tuttavia, il cicloesano viene utilizzato anche nella produzione di benzene, cicloesil cloruro, nitrociloesano, cicloesanolo e cicloesanone; nella produzione di combustibile solido; in formulazioni fungicide; e nella ricristallizzazione industriale degli steroidi.
Applicazioni di minoranza
Una frazione molto piccola del ciclo prodotto viene utilizzata come solvente non polare per l'industria chimica e diluente nelle reazioni polimeriche. Può anche essere usato come smo nella vernice e vernice; nell'estrazione di oli essenziali; e sostituti di vetro.
Per le sue proprietà chimiche e conformazionali uniche, il cicloesano viene utilizzato anche nei laboratori chimici analitici per le determinazioni del peso molecolare e come standard.
Produzione
Processo tradizionale
Il cicloesano è presente in petrolio greggio in concentrazioni che variano tra 0.1 e 1.0%. Pertanto, era tradizionalmente prodotto dalla distillazione frazionaria della benzina in cui era ottenuto un concentrato di cicloesano dell'85%.
Può servirti: atomo di carbonio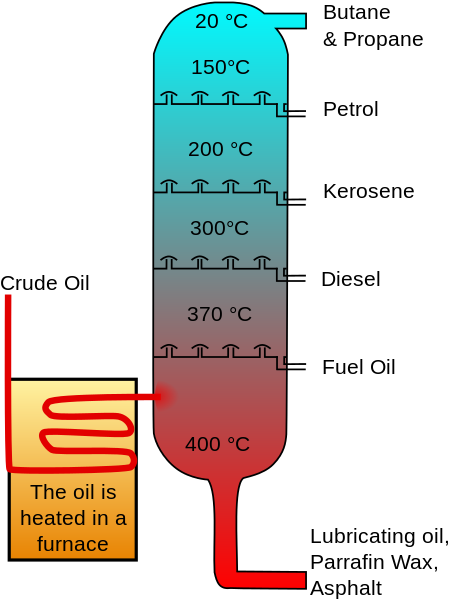 Distillazione dell'olio frazionata. Grezzo_oil_distillation-fr.SVG: immagine originale: Psaria, Theresa Knott; Immagine Vectorielle: RogilberTerivative Work: Utain ()/CC BY-SA (http: // creativeCommons.Org/licenze/by-sa/3.0/)
Distillazione dell'olio frazionata. Grezzo_oil_distillation-fr.SVG: immagine originale: Psaria, Theresa Knott; Immagine Vectorielle: RogilberTerivative Work: Utain ()/CC BY-SA (http: // creativeCommons.Org/licenze/by-sa/3.0/) Questo concentrato è stato venduto, poiché è necessaria un'ulteriore purificazione per eseguire un processo di isomerizzazione di pentani, cracking di calore per eliminare gli idrocarburi a catena aperta e il trattamento dell'acido solforico per rimuovere i composti aromatici.
Gran parte della difficoltà di ottenere cicloesano con maggiore purezza era dovuta al gran numero di componenti di petrolio con punti di ebollizione simili.
Processo ad alta efficienza
Al momento, il cicloesano si verifica su scala industriale reagendo il benzene con idrogeno (idrogenazione catalitica) a causa della semplicità del processo e della sua alta efficienza.
Questa reazione può essere effettuata utilizzando metodi di fase liquida o di vapore in presenza di un catalizzatore altamente disperso o in un letto catalitico fisso. Sono stati sviluppati diversi processi in cui nichel, platino o paladio sono usati come catalizzatore.
La maggior parte delle piante di cicloesano utilizza il gas riformatore prodotto dal benzene e grandi quantità di idrogeno mediante prodotti come materia prima per la produzione di cicloesano.
Poiché i costi di idrogeno e benzene sono fondamentali per la produzione di cicloesano in modo redditizio, le piante si trovano di solito vicino a grandi raffinerie in cui sono disponibili materie prime a basso contenuto.
Riferimenti
- Campbell, m. L. (2014). Cicloesano. L'enciclopedia di chimica industriale di Ullmann (7th ed.). New York: John Wiley & Sons.
- McMurry, J. (2011). Fondamenti di chimica organica (7th ed.). Belmont: Brooks/Cole.
- Centro nazionale per le informazioni sulla biotecnologia. (2020) Database PubChem. Cicloesano, cid = 8078. Bethesda: National Library of Medicine. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov
- Ouellette, r. J., & Rawn, J. D. (2014). Chimica organica - Struttura, meccanismo e sintesi. San Diego: Elsevier.
- Petrucci, r. H., Harring, f. G., Bissonnette, c., & Maturo, j. D. (2017). Chimica generale: principi e applicazioni moderne (11th ed.). New York: Pearson.
- Salomoni, t. W., Fryhle, c. B., & Snyder, s. A. (2016). Chimica organica (12th ed.). Hoboken: John Wiley & Sons.
- Wade, l. G. (2013). Chimica organica (8a ed.). New York. Pearson.

