Proprietà del ciclismo, reazioni, usi, esempi
- 4489
- 920
- Lino Lombardi
IL Cicloalcano Sono una famiglia di idrocarburi saturi con una formula generale di CNH2n Ciò coincide con quello degli alcheni; con la differenza che l'apparente insaturazione non è dovuta a un doppio legame, ma a un anello o un ciclo. Ecco perché sono considerati isomeri alquenos.
Questi sono formati quando gli alcani lineari uniscono le estremità delle loro catene per originare una struttura chiusa. Come per gli alcani, il cicloalcano può esibire dimensioni, masse molecolari, sostituzioni o persino sistemi composti da più di un anello (policiclici).
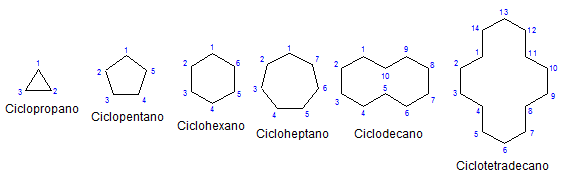
 Alcuni cicloalcani monociclici. Fonte: Mephisto Spa via Wikipedia.
Alcuni cicloalcani monociclici. Fonte: Mephisto Spa via Wikipedia. Del resto, chimica e fisicamente sono simili agli alcani. Hanno solo carboni e idrogeni, sono molecole neutre e quindi interagiscono attraverso le forze di van der Walls. Servono anche da carburanti, rilasciando calore quando bruciano in presenza di ossigeno.
Perché i cicloalcani sono più instabili delle loro controparti a catena aperta? Il motivo può essere sospettato osservando gli esempi di cicloalcani rappresentati nell'immagine superiore: ci sono tensioni e impedimenti sterici (spaziali).
Si noti che meno carboni (elencati in blu), più è chiusa la struttura; E il contrario accade quando aumentano, girando come una collana.
I piccoli cicloalcani sono gassosi e man mano che le loro dimensioni aumentano le loro forze intermolecolari. Di conseguenza, possono essere liquidi in grado di dissolvere grassi e apolare, lubrificante o solidi che sembrano colori scuri e qualità come i colori dell'asfalto.
[TOC]
Proprietà fisiche e chimiche
Polarità
Se composti solo da carboni e idrogeni, gli atomi che non differiscono troppo nell'elettronegatività, questo rende le molecole di cicloalc e quindi mancano di un momento di dipolo.
Non possono interagire attraverso le forze dipolo-dipolo, ma dipendono specificamente dalle forze di Londra, che sono deboli ma che aumentano con la massa molecolare. Ecco perché i piccoli cicloalcani (con meno di cinque carboni) sono gassosi.
Interazioni intermolecolari
D'altra parte, dal momento che sono anelli, i cicloalcani hanno una maggiore area di contatto, che favorisce le forze di Londra tra le loro molecole. Pertanto, sono raggruppati e interagiscono meglio rispetto agli alcani; E quindi i suoi punti di ebollizione e fusione sono più alti.
Inoltre, poiché hanno due atomi di idrogeno in meno (cNH2n Per i cicloalcani e cNH2n+2 Per gli alcani), sono più leggeri; E aggiungendo a questo il fatto della sua più grande area di contatto, riduce il volume occupato dalle sue molecole e, quindi, sono più denser.
Saturazione
Perché i cicloalcani sono classificati con idrocarburi saturi? Perché hanno il modo in cui incorporano una molecola di idrogeno; A meno che l'anello non si apra, e in quel caso diventerebbero semplici alcani. Perché un idrocarburo sia considerato saturo, deve avere il numero massimo possibile di collegamenti C-H.
Può servirti: potenziometro (fameter)Stabilità
Chimicamente sono molto simili agli alcani. Entrambi hanno collegamenti C-C e C-H, che non sono così facili da rompere per causare altri prodotti. Tuttavia, la loro stabilità relativa differisce, che può essere verificata sperimentalmente misurando i loro calcoli a combustione (ΔHpettine).
Ad esempio, se confrontato ΔHpettine Per propano e ciclopropo (rappresentato da un triangolo nell'immagine), vi sono 527,4 kcal/mol e 498,9 kcal/mol, rispettivamente.
Il dettaglio è che il ciclopropanopettine minore (471 kcal/mol) perché sono tre gruppi di metilene, Cho2; Ma in realtà, rilascia più calore, riflettendo l'instabilità maggiore della stimata. Questa energia in eccesso si dice che è dovuta a tensioni all'interno del ring.
E in effetti, queste tensioni governano e differenziano la reattività o la stabilità dei cicloalcani, rispetto agli alcani, contro reazioni specifiche. Finché le tensioni non sono molto elevate, i cicloalcani tendono ad essere più stabili dei rispettivi top.
Nomenclatura
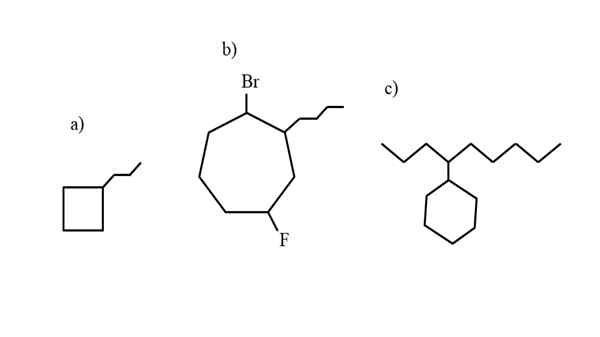 Alcuni esempi di cicloalcan sostituito per testare le regole di nomenclatura. Fonte: Gabriel Bolívar.
Alcuni esempi di cicloalcan sostituito per testare le regole di nomenclatura. Fonte: Gabriel Bolívar. La nomenclatura governata dall'IUPAC per i cicloalcani non differisce troppo di quella degli alcani. La regola più semplice di tutti è quella di posizionare il prefisso del ciclo al nome dell'alcano di cui si forma il cicloalcano.
Pertanto, ad esempio, del Nesano N, Cho3Cap2Cap2Cap2Cap2Cap3, Cyclohexan è ottenuto (rappresentato da un esagono nella prima immagine). Allo stesso modo accade con ciclopropano, ciclobutano, ecc.
Ora, questi composti possono subire sostituzioni da uno dei loro idrogeni. Quando il numero di carboni dell'anello è superiore a quello dei sostituenti a noleggio, l'anello viene preso come catena principale; Questo è il caso di a) per l'immagine superiore.
Si noti che in a) il ciclobutano (il quadrato) ha più carboni del gruppo Propilus collegato ad esso; Quindi questo composto è chiamato propylciclobutano.
Se c'è più di un sostituente, dovrebbero essere nominati in ordine alfabetico e in modo tale che abbiano il numero di localizzazione meno possibile. Ad esempio, b) è chiamato: 1-Bromo-4-Fluoro-2-butilcicloheptano (e non 1-bromo-5-fluoro-7-butilcicloheptano, che sarebbe errato).
E infine, quando il sostituente alquilicico ha più carboni del ring, si dice che quest'ultimo sia il gruppo sostitutivo della catena principale. Quindi, c) è chiamato: 4-cyclohexilnonano.
Può servirti: ossidi di metalloStruttura
Lasciando da parte i cycan sostituiti, è conveniente concentrarsi solo sulle loro basi strutturali: gli anelli. Questi erano rappresentati nella prima immagine.
Quando li osserva, la falsa idea può sorgere che tali molecole sono piatte; Ma con l'eccezione di Ciclopropo, le sue superfici sono "Zigzagenantes", con i carboni che scendono o caricano in relazione allo stesso piano.
Questo perché per iniziare tutti i carboni hanno l'ibridazione SP3, e quindi presenti geometrie tetraedriche con angoli di collegamento a 109,5º. Ma, se la geometria degli anelli è attentamente osservata, è impossibile che i loro angoli siano; Ad esempio, gli angoli all'interno del triangolo ciclopropano sono 60º.
Questo è ciò che è noto come tensione angolare. Maggiore è gli anelli, l'angolo tra i collegamenti C-C è più vicino a 109,5º, il che provoca una diminuzione di tale tensione e un aumento della stabilità per i cicloalcani.
Un altro esempio è osservato nel ciclobutano, i cui angoli di collegamento sono 90º. Già nel ciclopentano i suoi angoli sono 108º, e dal cicloesano si dice quindi che la tensione angolare cessa di esercitare un tale effetto di osservazione, quindi ha osservato.
Conformazioni
Oltre alla tensione angolare, ci sono altri fattori che contribuiscono alla tensione sperimentata dai cicloalcani.
I collegamenti C-C non possono ruotare senza di più, poiché ciò implicherebbe che l'intera struttura "rabbrividisce". Pertanto, queste molecole possono adottare conformazioni spaziali molto ben definite. Lo scopo di questi movimenti è ridurre le tensioni causate dall'eclissi degli atomi di idrogeno; Cioè, quando uno davanti all'altro.
Ad esempio, le conformazioni per il ciclobutano assomigliano a una farfalla che batte le ali; quelli del ciclopentano, una busta; Quelli del cicloesano, una barca o una sedia, e più grande è l'anello, maggiore è il numero e le forme che possono adottare nello spazio.
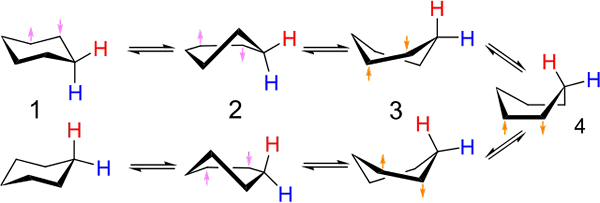 Investimenti tra sedia e conformazione del tipo di barca per il cicloesano. Fonte: Kministi [CC0].
Investimenti tra sedia e conformazione del tipo di barca per il cicloesano. Fonte: Kministi [CC0]. L'immagine superiore mostra un esempio di tali conformazioni per il cicloesano. Nota che il presunto esagono piatto sembra davvero più una sedia (a sinistra dell'immagine) o una barca (a destra). Un idrogeno è rappresentato con testi rossi e un altro con testi blu, per indicare come cambiano le loro posizioni relative dopo gli investimenti.
In (1), quando l'idrogeno è perpendicolare al piano ad anello, si dice che sia in posizione assiale; E quando è parallelo a questo, si dice che sia in posizione equatoriale.
Reazioni
Le reazioni che i cicloalcan possono soffrire sono le stesse degli alcani. Entrambi bruciano in presenza di un eccesso di ossigeno nelle tipiche reazioni di combustione per produrre anidride carbonica e acqua. Allo stesso modo, entrambi possono subire alogenizioni, in cui un idrogeno viene sostituito da un atomo alogeno (F, Cl, Br, I).
Può servirti: vantaggi e svantaggi della chimica della salute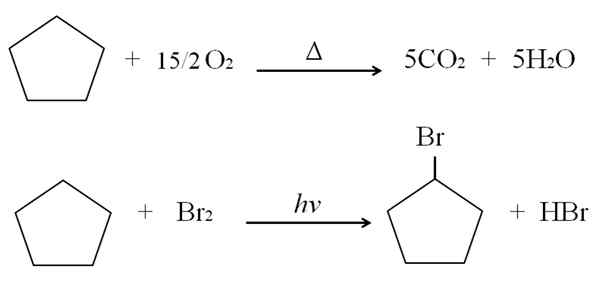 Reazioni ciclopentano. Fonte: Gabriel Bolívar.
Reazioni ciclopentano. Fonte: Gabriel Bolívar. Sopra le reazioni di combustione e alogenazione per ciclopentano sono mostrate come esempio. Una talpa brucia in presenza di calore e 7,5 moli di ossigeno molecolare per rompersi in CO2 e h2O. D'altra parte, in presenza di ultravioletto e bromo.
Applicazioni
L'uso di cicloalcani dipende in gran parte dal loro numero di carboni. Il più leggero, e quindi gassoso, una volta servito per alimentare le lampade a gas delle luci pubbliche.
I liquidi, nel frattempo, hanno profitti come solventi di oli, grassi o prodotti commerciali di natura apolare. Tra questi puoi menzionare Ciclopentano, Cyclohexan e Cycloheptane. Allo stesso modo, vengono spesso utilizzati nelle operazioni di routine nei laboratori di Petróleos o nella formulazione del carburante.
Se sono più pesanti, possono essere usati come lubrificanti. D'altra parte, possono anche rappresentare il materiale di partenza per la sintesi dei farmaci; Come il carboplatino, che include nella sua struttura un anello di ciclobutano.
Esempi di CyChannel
Infine, viene restituito all'inizio dell'articolo: l'immagine con diversi cicloalcani non messi a punto.
Per memorizzare i cicloalcani, è sufficiente pensare alle figure geometriche: triangolo (ciclopropano), quadrato (ciclobutano), pentagono (ciclopentano), esagono.
Più grande è l'anello, meno ricorda la sua rispettiva figura geometrica. È già stato visto che il cicloesano è tutto tranne un esagono; Lo stesso accade più evidentemente con il ciclootetradecano (quattordici carboni).
Arriva un punto in cui si comporteranno come collane che possono essere piegate per ridurre al massimo le tensioni dei loro collegamenti ed eclissi.
Riferimenti
- Morrison, r. T. e Boyd, r, n. (1987). Chimica organica. 5a edizione. Editoriale Addison-Wesley Inter-American.
- Carey f. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Graham Solomons t.W., Craig b. Frigorifero. (2011). Chimica organica. Ammine. (10a edizione.). Wiley Plus.
- Chimica librettexts. (2 giugno 2019). Cicloalcani di denominazione. Recuperato da: Chem.Librettexts.org
- Wikipedia. (2019). Cicloalcano. Recuperato da: in.Wikipedia.org
- Clark Jim. (2015). Presentazione di alkaes e cicloalcani. Recuperato da: ChemGuide.co.UK
- James Ashenhurst. (2019). Conformazioni e cicloalcani. Chimica organica principale. Recuperato da: MasterOrganicChemistry.com
- Fernández Germán. (S.F.). Cicloalcanos-toria. Chimica organica. Recuperato da: Chemicicaorganica.org

