Fase del ciclo di carnot, applicazioni, esempi, esercizi
- 3689
- 36
- Rosolino Santoro
Lui Ciclo di carnot È la sequenza di processi termodinamici che si svolgono in un motore Carnot, un dispositivo ideale che consiste solo in processi reversibili; Cioè coloro che, avendo avuto luogo, possono tornare allo stato iniziale.
Questo tipo di motore è considerato ideale, poiché manca di dissipazione, attrito o viscosità che si presentano in macchine reali, trasformando l'energia termica in un lavoro utilizzabile, sebbene la conversione non sia effettuata al 100%.
 Figura 1. Una locomotiva a vapore. Fonte: Pixabay
Figura 1. Una locomotiva a vapore. Fonte: Pixabay Un motore è costruito in base a una sostanza in grado di fare lavoro, come gas, benzina o vapore. Questa sostanza è soggetta a varie variazioni di temperatura e a sua volta sperimenta variazioni della sua pressione e volume. In questo modo è possibile spostare un pistone all'interno di un cilindro.
[TOC]
Qual è il ciclo Carnot?
Il ciclo Carnot si svolge all'interno di un sistema chiamato motore Carnot o C, che è un gas ideale bloccato in un cilindro e dotato di un pistone, che è in contatto con due fonti a temperature diverse1 e T2 come quello mostrato nella figura seguente a sinistra.
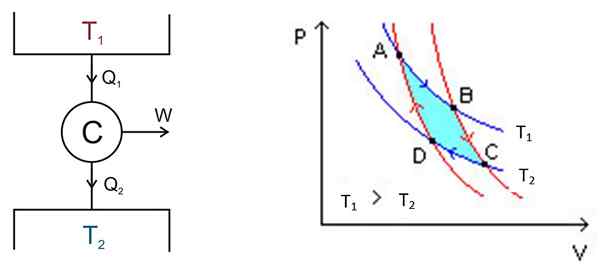 figura 2. A sinistra uno schema della macchina C Arnot, a destra il diagramma PV. Fonte della figura sinistra: keta - proprio lavoro, cc di 2.5, https: // Commons.Wikimedia.org/w/indice.PHP?Curid = 681753, figura destra Wikimedia Commons.
figura 2. A sinistra uno schema della macchina C Arnot, a destra il diagramma PV. Fonte della figura sinistra: keta - proprio lavoro, cc di 2.5, https: // Commons.Wikimedia.org/w/indice.PHP?Curid = 681753, figura destra Wikimedia Commons. Ci sono i seguenti processi in modalità approssimativa:
- Una certa quantità di calore viene fornita al dispositivoEntrata = Q1 Dal serbatoio termico ad alta temperatura t1.
- Il motore Carnot C esegue un lavoro w grazie a questo calore fornito.
- Una parte del calore utilizzato: i rifiuti QUscita, Viene trasferito nel serbatoio termico che è a una temperatura inferiore t2.
Fase del ciclo di carnot
L'analisi è effettuata da un diagramma P -V (volume di pressione), come mostrato nella Figura 2 (figura a destra). L'obiettivo del motore può essere quello di mantenere il deposito termico 2 freddo, estraendo calore da esso. In questo caso è un Macchina refrigerante. Se al contrario, si desidera dare calore al deposito termico 1, allora è un Pompa di calore.
Il diagramma P -V mostra variazioni di pressione - temperatura del motore in due condizioni:
- Mantenere la temperatura costante (processo isotermico).
- Nessun trasferimento di calore (isolamento termico).
I due processi isotermici devono essere collegati, il che si ottiene mediante isolamento termico.
Punto
Puoi iniziare in qualsiasi momento del ciclo, in cui il gas ha una certa pressione, volume e condizioni di temperatura. Il gas subisce una serie di processi e può tornare alle condizioni di partenza per iniziare un altro ciclo, e sempre l'energia interna finale è la stessa della iniziale. Poiché l'energia è conservata:
Lavoro svolto da C = calore di ingresso - calore di partenza
ΔW = QEntrata - QUscita
L'area inclusa in questo ciclo o loop, in turchese nella figura, è uguale proprio al lavoro svolto dal motore Carnot.
I punti A, B, C e D sono contrassegnati nella Figura 2. Inizierà dal punto di seguire la freccia blu.
Primo stadio: espansione isotermica
La temperatura tra i punti A e B è T1. Il sistema assorbe il calore dal deposito termico 1 e subisce un'espansione isotermica. Quindi il volume aumenta e la pressione diminuisce.
Tuttavia, la temperatura rimane in t1, Da quando il gas lo espande si raffredda. Pertanto, la sua energia interna rimane costante.
Può servirti: Graff Van Generator: Party, come funziona, applicazioniSecondo stadio: espansione adiabatica
Nel punto B il sistema inizia una nuova espansione in cui il sistema non vince o perde calore. Ciò si ottiene mettendolo nell'isolamento calorico come indicato in precedenza. Pertanto è un'espansione adiabatica che continua a puntare C seguendo la freccia rossa. Il volume aumenta e la pressione diminuisce fino a raggiungere il suo valore più basso.
Terza fase: compressione isotermica
Inizia dal punto C e finisci in D. L'isolamento viene rimosso e il sistema viene a contatto con il deposito termico 2, la cui temperatura t2 È meno. Il sistema produce il calore dei rifiuti sul serbatoio termico, la pressione inizia ad aumentare e il volume per diminuire.
Quarto stadio: compressione adiabatica
Raggiunto al punto D, il sistema risale all'isolamento termico, la pressione aumenta e il volume diminuisce fino a raggiungere le condizioni originali del punto A. Quindi il ciclo viene nuovamente ripetuto.
Il teorema di Carnot
Il teorema di Carnot fu postulato per la prima volta all'inizio del XIX secolo dal fisico francese Sadi Carnot. Nell'anno del 1824 Carnot, che faceva parte dell'esercito francese, pubblicò un libro in cui propose la risposta alla seguente domanda: in quali condizioni una macchina termica ha la massima efficienza? Carnot ha quindi stabilito quanto segue:
Nessun motore termico che scorre tra due depositi termici è più efficiente del motore Carnot.
La resa η di un motore termico è data dal rapporto tra il lavoro svolto W e il calore assorbito Q:
prestazioni = lavoro svolto/calore assorbito
In questo modo, le prestazioni di qualsiasi motore termico i sono: η = w/q. Mentre le prestazioni di un motore Carnot R sono η '= W/Q', nel caso di entrambi i motori sono in grado di eseguire lo stesso lavoro.
Il teorema di Carnot afferma che η non è mai maggiore di η '. Altrimenti cade in contraddizione con la seconda legge della termodinamica, in base al quale un processo in cui il risultato è che il calore da un corpo di temperatura inferiore è impossibile andare a un'altra temperatura più elevata senza ricevere un aiuto esterno. Perciò:
η < η'
Dimostrazione del teorema di Carnot
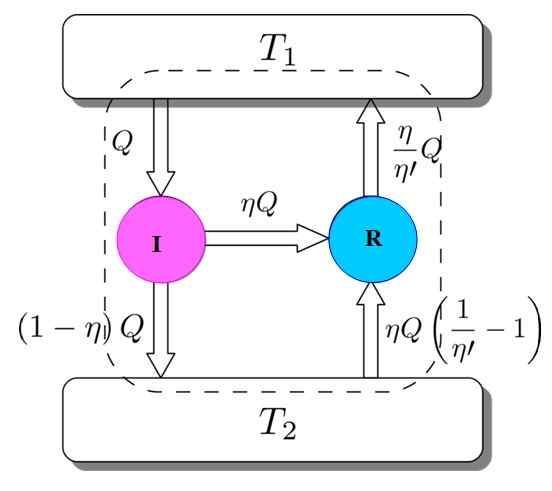
Per dimostrare che è così, considera il motore Carnot che agisce come una macchina per frigorifero guidata da un motore I. Ciò è possibile poiché il motore Carnot funziona con processi reversibili, come specificato all'inizio.
 Figura 3. Dimostrazione del teorema di Carnot. Fonte: NETHERIL96 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]
Figura 3. Dimostrazione del teorema di Carnot. Fonte: NETHERIL96 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)] Hai entrambi: io e r lavorano con gli stessi depositi termici e si presume che η > η'. Se lungo la strada viene raggiunta una contraddizione con la seconda legge della termodinamica, il teorema di Carnot è dimostrato dalla riduzione dell'assurdità.
La Figura 3 aiuta a seguire il processo. Il motore I prende una quantità di calore q, che si divide in questo modo: fare lavoro su r equivalente a w = ηq e il resto è il calore trasferito (1 -η) q al serbatoio termico t2.
Poiché l'energia è conservata, tutto è soddisfatto:
EEntrata = Q = lavoro w + calore assegnato a t2 = ηq + (1 -η) Q = EUscita
Ora la macchina del frigorifero Carnot R prende il serbatoio termico 2 una quantità di calore data da:
Può servirti: imantation: cosa consiste, metodo ed esempi(η / η ') (1 -η') Q =
L'energia deve anche essere mantenuta in questo caso:
EEntrata = ηq + (η / η ') (1 -η') q = (η / η ') q = q' = eUscita
Il risultato è il trasferimento nel serbatoio termico t2 di una quantità di calore dato da (η / η ') Q = Q'.
Se η è maggiore di η 'significa che il deposito termico a temperatura più alta è arrivato più calore di quello che ho preso in origine. Poiché nessun agente esterno, come un'altra fonte termica, ha partecipato, l'unico modo in cui potrebbe accadere è che il deposito termico più freddo produce il calore.
Questo non è d'accordo con la seconda legge della termodinamica. Si è concluso quindi che non è possibile che η' Essere meno di η, quindi il motore I non può avere più prestazioni della macchina Carnot R.
Teorema corollario e limitazioni
Il corollario del teorema di Carnot afferma che due macchine per carnot hanno la stessa efficienza se entrambi operano con gli stessi depositi termici.
Ciò significa che la sostanza non ha importanza, la performance è indipendente e non può essere sollevata cambiandola.
La conclusione dell'analisi precedente è che il ciclo di carnot è la parte superiore del processo termodinamico idealmente raggiungibile. In pratica ci sono molti fattori che riducono l'efficienza, ad esempio il fatto che l'isolamento non è mai perfetto e nelle fasi adiabatiche c'è effettivamente uno scambio calorico con l'esterno.
Nel caso di un'auto, il blocco del motore viene riscaldato. D'altra parte, la miscela di gas e aria non si comporta esattamente come un gas ideale, che è il punto di partenza del ciclo Carnot. Questo per menzionare solo alcuni fattori che causano una drastica riduzione delle prestazioni.
Esempi
Un pistone all'interno di un cilindro
Se il sistema è un pistone bloccato in un cilindro come nella Figura 4, il pistone si alza durante l'espansione isotermica, come si può vedere nel primo schema della sinistra estrema e sorge anche durante l'espansione adiabatica.
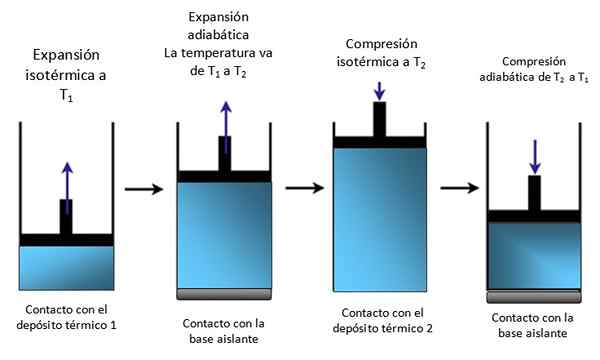 Figura 4. Movimento di un pistone all'interno di un cilindro. Fonte: sé realizzato.
Figura 4. Movimento di un pistone all'interno di un cilindro. Fonte: sé realizzato. Quindi isotermicamente compresso, dando calore e continua a comprimere adiabaticamente. Il risultato è un movimento in cui il pistone si alza e giù all'interno del cilindro e può essere trasmesso ad altre parti di un determinato dispositivo, come ad esempio un motore automobilistico, che produce una coppia o una macchina piena di vapore.
Vari processi reversibili
Oltre all'espansione e alla compressione di un gas ideale all'interno di un cilindro, ci sono altri processi reversibili ideali con cui può essere configurato un ciclo di carnot, ad esempio:
- Movimenti di andata e ritorno in assenza di attrito.
- Una molla ideale che è compressa e decompressa e che non è mai deformata.
- Circuiti elettrici in cui non vi sono resistenza che dissipa l'energia.
- Cicli di magnetizzazione e demagnetizzazione in cui non ci sono perdite.
- Caricamento e download di una batteria.
Una centrale nucleare
Mentre è un sistema molto complesso, un primo approccio di ciò che è necessario per produrre energia nel reattore nucleare è quello che segue:
- Una fonte termica, costituita da un materiale che si disintegra in radioattivamente come l'uranio.
Può servirti: modello atomico attuale- Il lavandino o il deposito termico freddo che sarebbe l'atmosfera.
- La "macchina Carnot" che utilizza un fluido, quasi sempre acqua corrente, che viene fornita calore dalla sorgente termica per trasformarlo in vapore.
Quando il ciclo viene eseguito, l'elettricità viene ottenuta come lavoro netto. Se trasformata in vapore ad alta temperatura, l'acqua viene raggiunta su una turbina, dove l'energia viene trasformata in movimento o energia cinetica.
La turbina a sua volta attiva un generatore elettrico che trasforma l'energia del suo movimento in elettricità. Oltre al materiale di accoglienza come l'uranio, ovviamente i combustibili fossili possono essere utilizzati come fonte di calore.
Esercizi risolti
-Esempio 1: efficienza di una macchina termica
L'efficienza di una macchina termica è definita come il rapporto tra il lavoro di uscita e il lavoro di ingresso, e quindi è una quantità senza dimensioni:
Massima efficienza = (QEntrata - Q Uscita) /QEntrata
Indicando la massima efficienza come Emax, È possibile dimostrare la sua dipendenza dalla temperatura, che è la variabile più semplice da misurare, come: ad esempio:
Emax = 1 - (t2/T1)
Dove2 È la temperatura del lavandino e t1 È la temperatura della sorgente termica. Poiché quest'ultimo è maggiore, l'efficienza risulta sempre inferiore a 1.
Supponiamo che una macchina termica sia in grado di lavorare sui seguenti modi: a) tra 200 K e 400 K, b) tra 600 K e 400 K. Qual è l'efficienza in ogni caso?
Soluzione
a) Nel primo caso l'efficienza è:
EMax1 = 1 - (200/400) = 0.cinquanta
b) Per la seconda modalità l'efficienza sarà:
EMax2 = 1- (400/600) = 0.33
Sebbene la differenza di temperatura sia la stessa tra le due modalità, l'efficienza non lo è. E ancora più notevole è che la modalità più efficiente funziona a temperatura più bassa.
-Esempio 2: calore assorbito e calore ceduto
Una macchina termica del 22 % produce 1530 J di lavoro. Trova: a) La quantità di calore assorbita dal deposito termico 1, b) la quantità di calore scartata nel serbatoio termico 2.
a) In questo caso la definizione di efficienza viene utilizzata, poiché è disponibile il lavoro svolto, non delle temperature dei depositi termici. 22% di efficienza significa che E Max = 0.22, quindi:
Massima efficienza = lavoro /qEntrata
La quantità di calore assorbita è precisamente QEntrata, Quindi cancella che hai:
QEntrata = Lavoro/efficienza = 1530 J/0.22 = 6954.5 J
b) La quantità di calore assegnata al serbatoio più freddo proviene da ΔW = QEntrata - QUscita
QUscita = QEntrata - ΔW = 6954.5 -1530 J = 5424.5 J.
Un altro modo è da Emax = 1 - (t2/T1). Poiché le temperature non sono note, ma queste sono legate al calore, l'efficienza può anche essere espressa come:
Emax = 1 - (QScarsamente/Qassorbito)
Riferimenti
- Bauer, w. 2011. Fisica per ingegneria e scienze. Volume 1. Mc Graw Hill. 654-657
- Energia nucleare. Funzionamento di una centrale nucleare. Recuperato da: energia-nucleare.netto
- Serway, r., Jewett, J. (2008). Fisica per la scienza e l'ingegneria. Volume 1. 7 °. Ed. Apprendimento del Cengage. 618-622.
- Tippens, p. 2011. Fisica: concetti e applicazioni. 7a edizione. MacGraw Hill. 414-416.
- Walker, J.2008. Fisica. 4a ed.Addison Wesley. 610-630

