Struttura del carburo di calcio (CAC2), proprietà, ottenimento, usi

- 2231
- 87
- Lidia Valentini
Lui Carburo di Calcio È un composto inorganico formato da elementi di calcio (Ca) e carbonio (C) (C). La sua formula chimica è CAC2. È un solido che può essere incolore al bianco giallastro o grigiastro e persino nero a seconda delle impurità che contiene.
Una delle sue più importanti reazioni chimiche del CAC2 è quello che si verifica con l'acqua h2Oppure, in cui si forma HC≡ch acetilene. Pertanto viene utilizzato per ottenere acetilene industrialmente. A causa di quella stessa reazione d'acqua viene utilizzata per maturare frutti, in cannoni finti e nei razzi navali.
 Carburo di calcio CAC2 solido. Dominio Ondřej mangl / pub. Fonte: Wikimedia Commons.
Carburo di calcio CAC2 solido. Dominio Ondřej mangl / pub. Fonte: Wikimedia Commons. La reazione del CAC2 Con l'acqua produce anche un utile fango per preparare clinker (un componente di cemento), che produce meno anidride carbonica (CO2) Se confrontato con il metodo tradizionale per produrre cemento.
Con azoto (n2) Carburo di calcio in forma di cianamide di calcio, che viene utilizzato come fertilizzante. Il CAC2 Viene anche usato per rimuovere lo zolfo da alcune leghe metalliche.
Qualche tempo fa il CAC2 È stato usato nelle lampade in carburo così chiamate, ma queste non sono più molto comuni perché sono pericolose.
[TOC]
Struttura
Il carburo di calcio è un composto ionico ed è formato dal calcio CA2+ e il carburo o l'acetiluro c22-. Lo ione in carburo è costituito da due atomi di carbonio uniti da un triplo legame.
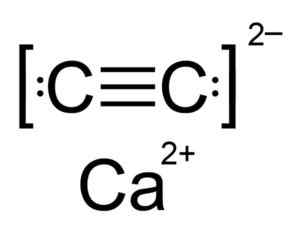 Struttura chimica del carburo di calcio. Autore: Hellbus. Fonte: Wikimedia Commons.
Struttura chimica del carburo di calcio. Autore: Hellbus. Fonte: Wikimedia Commons. La struttura cristallina del CAC2 È derivato dal cubico (come NaCl di cloruro di sodio), ma come ioni c22- La struttura è allungata è distorta e diventa tetragonale.
Nomenclatura
- Carburo di Calcio
- Carburo di Calcio
- Acetilico di calcio
Proprietà
Stato fisico
Solido cristallino che quando puro è incolore, ma se è contaminato con altri composti può essere giallastro o grigiastro a nero.
 Carburo di calcio CAC2 Con impurità. LeIEM/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0). Fonte: Wikimedia Commons.
Carburo di calcio CAC2 Con impurità. LeIEM/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0). Fonte: Wikimedia Commons. Peso molecolare
64.0992 g/mol
Può servirti: Alilo: unità allyica, carbocalizzazione, radicale, esempiPunto di fusione
2160 ºC
Punto di ebollizione
Il CAC2 bolle a 2300 ºC con decomposizione. Il punto di ebollizione deve essere misurato in atmosfera inerte, cioè senza ossigeno o umidità.
Densità
2,22 g/cm3
Proprietà chimiche
Il carburo di calcio reagisce con l'acqua per formare HCth acetilene e idrossido di calcio (OH)2:
CAC2 + 2 h2O → HC≡CH + CA (OH)2
L'acetilene è infiammabile, quindi in presenza di umidità il CAC2 Può essere infiammabile. Tuttavia, quando è asciutto non lo è.
 Carburo di calcio CAC2 Con forma di acetilene HC (Acqua, composto infiammabile. Kristina Kravets/CC BY-S (https: // creativeCommons.Org/licenze/by-sa/3.0). Fonte: Wikimedia Commons.
Carburo di calcio CAC2 Con forma di acetilene HC (Acqua, composto infiammabile. Kristina Kravets/CC BY-S (https: // creativeCommons.Org/licenze/by-sa/3.0). Fonte: Wikimedia Commons. Il carburo di calcio reagisce con azoto n2 Per formare CACN CALCIE CYANAMIDE2:
CAC2 + N2 → Cacn2 + C
Ottenimento
Il carburo di calcio è prodotto industrialmente in un forno ad arco elettrico basato su una miscela di carbonato di calcio (Caco3) e carbone (c) che viene presentato a una temperatura di 2000 ° C. La reazione è riassunta come segue:
Ladro3 + 3 C → CAC2 + CO ↑ + Co2↑
O anche:
CAO + 3 C → CAC2 + CO ↑
In un forno ad arco elettrico c'è un arco di elettricità tra due elettrodi di grafite, che resistono alle alte temperature che si formano. Si ottiene un carburo di calcio con purezza dell'80-85%.
Applicazioni
Nella produzione di acetilene
Industrialmente, viene utilizzata la reazione in carburo di calcio con acqua per produrre acetilene C2H2.
CAC2 + 2 h2O → HC≡CH + CA (OH)2
Questo è l'uso più importante del carburo di calcio. In alcuni paesi, l'acetilene è molto apprezzato, poiché consente di produrre polivinil cloruro, che è un tipo di plastica. Inoltre l'acetilene serve a eseguire saldature ad alte temperature.
 HC≡ch Acetilene Flame Metals a temperature molto elevate. Autore: ShutterBug75. Fonte: Pixabay.
HC≡ch Acetilene Flame Metals a temperature molto elevate. Autore: ShutterBug75. Fonte: Pixabay. Nel ridurre le emissioni di CO2
I resti ottenuti ottenendo l'acetilene a partire dal CAC2 (chiamati anche "fanghi di carburo di calcio" o "residui di carburo di calcio") servono ad essere utilizzati per ottenere clinker o cemento.
Può servirti: applicazioni tecnologiche dell'emissione elettronica degli atomiIl fango in carburo di calcio ha un alto contenuto di idrossido di calcio (CA (OH)2) (circa il 90%), un po 'di carbonato di calcio (Caco3) e ha un pH maggiore di 12.
 I residui di carburo di calcio possono essere utilizzati nell'attività di costruzione per preparare il calcestruzzo, riducendo così la generazione di CO2 di detto industria. Autore: Engin Akyurt. Fonte: Pixabay.
I residui di carburo di calcio possono essere utilizzati nell'attività di costruzione per preparare il calcestruzzo, riducendo così la generazione di CO2 di detto industria. Autore: Engin Akyurt. Fonte: Pixabay. Per questi motivi puoi reagire con SIO2 o al2O3 Formare un prodotto simile a quello ottenuto dal processo di idratazione del cemento.
Una delle attività umane che produce più co -emissioni2 È l'industria delle costruzioni. Il co2 Viene generato a est del carbonato di calcio durante la reazione per formare il calcestruzzo.
Usando il fango in carburo di calcio per sostituire il carbonato di calcio (Caco3) È stato scoperto che le co -emissioni sono ridotte2 Nel 39%.
Nel ottenere cianamide di calcio
Il carburo di calcio viene anche utilizzato industrialmente per ottenere cianamide di calcio Cacn2.
CAC2 + N2 → Cacn2 + C
Il cianamide di calcio ha l'uso come fertilizzante, perché con l'acqua del suolo diventa cianomide h2n = c = n, che fornisce azoto alle piante, un nutriente essenziale per questi.
Nell'industria metallurgica
Il carburo di calcio viene utilizzato per rimuovere le leghe come Ferroníquel. Il CAC è misto2 Con la lega fusa a 1550 ° C. Lo zolfo (i) reagisce con carburo di calcio e solfuro di calcio CAS e carbone C:
CAC2 + S → 2 C + CAS
La rimozione dello zolfo è favorita se la miscelazione è efficiente e il contenuto di carbonio in lega è basso. Il solfuro di calcio di Casclium galleggia sulla superficie della lega fusa dove opta e scartato.
In diversi usi
Il carburo di calcio è stato usato nell'eliminazione dello zolfo di ferro. Anche come combustibile nella produzione di acciaio e come potente desossidante.
Può servirti: sostituzione elettrofila aromatica: meccanismo ed esempiÈ usato per maturare la frutta. Dal carburo di calcio con acqua, viene generato acetilene, che induce la maturazione dei frutti, come le banane.
 Le banane possono maturare usando il carburo di calcio CAC2. Autore: Foto di Alexas. Fonte: Pixabay.
Le banane possono maturare usando il carburo di calcio CAC2. Autore: Foto di Alexas. Fonte: Pixabay. Il carburo di calcio è usato nei falsi cannoni per causare il rumore di esplosione forte che li caratterizza. Qui è anche usata la formazione di acetilene, che esplode con una scintilla all'interno del manufatto.
Il CAC2 Viene utilizzato per generare segnali in alto mare in razzi navali che auto -conservato.
Uso interrotto
Il CAC2 È stato usato nelle lampade in carburo così chiamate. Il funzionamento di questi consiste nell'acqua gocciolante sul carburo di calcio per formare acetilene, che accende e quindi fornisce luce.
Queste lampade sono state usate nelle miniere di carbone, ma il loro uso è stato interrotto a causa della presenza di gas metano Cho4 In queste miniere. Questo gas è infiammabile e la fiamma della lampada in carburo può farlo sparare o sfruttare.
 Lampada in carburo di calcio CAC2. Dominio Scehardt / pub. Fonte: Wikimedia Commons.
Lampada in carburo di calcio CAC2. Dominio Scehardt / pub. Fonte: Wikimedia Commons. Erano ampiamente usati nelle miniere di roccia in ardesia, rame e stagno, e anche nelle prime auto, motociclette e biciclette, come luci anteriori o fari.
Sono stati attualmente sostituiti da lampade elettriche o addirittura lampade a LED. Tuttavia, sono ancora usati in paesi come la Bolivia, nelle miniere d'argento di Potosí.
Rischi
Carburo di calcio CAC2 secco non è infiammabile ma in presenza di umidità acetilene, che è.
Per estinguere un incendio in presenza di CAC2 Acqua, schiuma, anidride carbonica o estintori alogeni non devono mai essere usati. L'idrossido di sodio o calcio deve essere utilizzato.
Riferimenti
- Ropp, r.C. (2013). Gruppo 14 (C, SI, GE, SN e PB) Composti Terra alcalini. Carbidi di calcio. Nell'enciclopedia dei composti terrestri alcalini. Recuperato da ScienceDirect.com.
- Pohanish, r. P. (2017). C. Calcio in carburo. Nel manuale di Sittig di sostanze chimiche e carcinio tossici e pericolosi (settima edizione). Recuperato da ScienceDirect.com.
- Sole, h. et al. (2015). Proprietà del ripristino in carburo di calcio chimicamente combinato e la sua inffezione sulle proprietà del cemento. Materiali 2015, 8, 638-651. NCBI recuperato.Nlm.NIH.Gov.
- Nie, Z. (2016). Eco-materiali e valutazione del ciclo di vita. Caso di studio: CO2 Analisi di emissione del clinker di fanghi in carburo di calcio. In produzione verde e sostenibile di materiale avanzato. Recuperato da ScienceDirect.com.
- Crundwell, f.K. Et al. (2011). Refining Ferronickel fuso. Rimozione dello zolfo. Nella metallurgia estrattiva di metalli del gruppo di nichel, cobalto e platino. Recuperato da ScienceDirect.com.
- Tressler, r.E. (2001). Ceramica strutturale e termostrutturale. Carburi. In enciclopedia di scienza dei materiali e tecnologia. Recuperato da ScienceDirect.com.
- Cotone, f. Albert e Wilkinson, Geoffrey. (1980). Chimica inorganica avanzata. Quarta edizione. John Wiley & Sons.
- « 10 vantaggi della corsa quotidiana per la salute
- Caratteristiche dei valori morali, formazione ed esempi »

