Struttura a carbonato di zinco (ZnCo3), proprietà, usi

- 4097
- 320
- Dante Morelli
Lui carbonato di zinco È un composto inorganico formato dagli elementi di zinco (Zn), carbonio (c) e ossigeno (O) (O). La sua formula chimica è ZnCo3. Lo zinco ha uno stato di ossidazione di +2, carbonio +4 e ossigeno -2.
È un solido incolore o bianco che si trova nella natura che forma il minerale Smithsonite, in cui può essere solo o con altri elementi come il cobalto o il rame, che gli danno una colorazione viola o verde rispettivamente.
 Smithsonita, Minerale Znco3. Rob Lavinsky, Irocks.Com-CC-BY-SA-3.0/cc BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0). Fonte: Wikimedia Commons.
Smithsonita, Minerale Znco3. Rob Lavinsky, Irocks.Com-CC-BY-SA-3.0/cc BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0). Fonte: Wikimedia Commons. Lo Znco3 È quasi insolubile in acqua, ma è facilmente sciolto in acidi diluiti, come lo ione carbonato in forma carbononica acida (H2Co3), che poi diventa il gas di CO2 e acqua.
È usato come antisettico nelle ferite animali e talvolta viene fornito nella dieta per evitare malattie causate dalla carenza di zinco.
Serve a ritardare il bruciato che alcune fibre, materie plastiche e gengive quando entrano in contatto con il fuoco. Consente di separare i minerali di arsenici tossici da altre rocce in modo sicuro.
È stato usato nelle paste dentifric per recuperare la dentina nei denti sotto lo sbiancamento.
[TOC]
Struttura
Lo Znco3 È formato da un catione Zn2+ e un anione co32-. Il carbonio nello ione carbonato ha uno stato di ossidazione di +4. Questo ione ha una struttura piatta con i tre atomi di ossigeno che circondano l'atomo di carbonio.
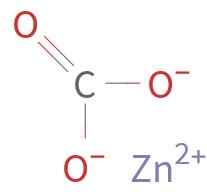 Struttura chimica del carbonato di zinco. Autore sconosciuto / dominio pubblico. Fonte: Wikimedia Commons.
Struttura chimica del carbonato di zinco. Autore sconosciuto / dominio pubblico. Fonte: Wikimedia Commons. Nomenclatura
- Carbonato di zinco
- Monocarbonato di zinco
- Sale di zinco acido carbonico
- Smithsonita
- Sputato di zinco
Proprietà
Stato fisico
Bianco incolore solido o cristallino. Cristalli rombici.
 Carbonato di zinco. Dominio Ondřej mangl / pub. Fonte: Wikimedia Commons.
Carbonato di zinco. Dominio Ondřej mangl / pub. Fonte: Wikimedia Commons. Peso molecolare
125,4 g/mol
Punto di fusione
A 140 ºC si rompe senza scioglimento.
Densità
4.398 g/cm3 a 20 ° C.
Solubilità
Praticamente insolubile in acqua: 0,000091 g/100 g di H2O a 20 ° C. Solubile in acidi diluiti, alcali e sali di ammonio. Insolubile in ammoniaca, alcol e acetone.
Proprietà chimiche
Reagisce con gli acidi che formano anidride carbonica:
Znco3 + 2 h+ → Zn2+ + H2O + co2↑
Si dissolve in basi che formano idrossido, che è parzialmente disciolto formando uno ione di zincato:
Può servirti: bromo: storia, struttura, configurazione elettronica, proprietà, usiZnco3 + 2 Oh- → Zn (OH)2 + Co32-
Zn (oh)2 + H2O + oh- → [Zn (OH)3(H2O)]-
Non è infiammabile. Se riscaldato alla sua decomposizione produce ossido di zinco e anidride carbonica, ma può emettere monossido di carbonio (CO).
Znco3 + Calore → ZnO + CO2↑
Ottenimento
Il minerale di Smithsonite è ottenuto, precedentemente chiamato Zinc's Spat.
Può anche essere preparato mescolando una soluzione di carbonato di sodio con un sale di zinco, come il solfato di zinco. Il solfato di sodio rimane disciolto e il carbonato di zinco precipita:
Znso4 + N / a2Co3 → Znco3↓ + Na2SW4
Applicazioni
Nei trattamenti medici
Questo composto consente di ottenere alcuni prodotti farmaceutici. Viene applicato alla pelle infiammata sotto forma di polvere o lozione.
In applicazioni veterinarie
Lo Znco3 Funge da protettore astringente, antisettico e topico degli animali negli animali.
Permette inoltre di prevenire le malattie causate dalla carenza di zinco, quindi viene utilizzato come integratore nella dieta di alcuni animali, a condizione che gli importi somministrati rientrino nelle norme stabilite dalle agenzie sanitarie.
 Il carbonato di zinco a volte viene somministrato come micronutriente per evitare le malattie nei suini. Autore sconosciuto / CC0. Fonte: Wikimedia Commons.
Il carbonato di zinco a volte viene somministrato come micronutriente per evitare le malattie nei suini. Autore sconosciuto / CC0. Fonte: Wikimedia Commons. Nei focolai di porcheratosi nei suini, viene aggiunto alla dieta di questi. Questa malattia è un'alterazione della pelle in cui lo strato di cornea non è correttamente formato.
Come ritardante di fiamma
Viene usato come riempimento ignifugo per gomma e materie plastiche esposte ad alte temperature. Ti consente di proteggere le fibre tessili dal fuoco.
Nel caso dei tessuti di cotone, viene applicato al tessuto insieme ad alcuni alcali. Questo attacca direttamente i gruppi idrossilici primari (-CH2Oh) di cellulosa e li rende sodioocellulosa (-ch2Ona).
La rottura dei collegamenti di cellulosa da parte dell'alcali favorisce una maggiore penetrabilità delle catene della struttura cellulosica compatta, in modo che più quantità di ZnCO3 riesce ad entrare nella zona amorfa di questo e la sua dispersione è facilitata.
Può servirti: vanadio: storia, proprietà, struttura, usi Alcuni tessuti di cotone possono contenere ZnCO3 nelle loro fibre per renderle resistenti al fuoco. Socken_farbig.JPEG: Scott Bauererivative Work: calzino / dominio pubblico. Fonte: Wikimedia Commons.
Alcuni tessuti di cotone possono contenere ZnCO3 nelle loro fibre per renderle resistenti al fuoco. Socken_farbig.JPEG: Scott Bauererivative Work: calzino / dominio pubblico. Fonte: Wikimedia Commons. Di conseguenza, la quantità di gas infiammabile che potrebbe verificarsi con il fuoco è ridotta.
Nei trattamenti dentali
Alcune creme dentifric basate su nanocristalli di carbonato di zinco e idrossiapatite applicati regolarmente alla protesi riducono l'ipersensibilità in modo più efficace rispetto a quelle basate sul fluoruro.
I nanocristalli di ZnCo3 e l'idrossiapatite ha dimensioni, forma, composizione chimica e cristallinità simili a quella della dentina, in modo che i tubuli dentinici possano essere chiusi con l'applicazione di questi materiali.
 Nanoparticelle Znco3-L'idrossiapitite è stato testato con successo per ridurre la sensibilità nei denti sbiancati. Autore: mix di foto. Fonte: Pixabay.
Nanoparticelle Znco3-L'idrossiapitite è stato testato con successo per ridurre la sensibilità nei denti sbiancati. Autore: mix di foto. Fonte: Pixabay. Questo tipo di paste dentifric era utile dopo i processi di sbiancamento dentale.
Per separare i minerali di arsenico pericoloso
I metodi minerali arsenici di rocce di zolfo (come galena, calcopirite e pirite) sono stati testati usando ZnCO)3. Il minerale nell'arsenico deve essere separato dagli altri perché questo elemento è un inquinante molto tossico e velenoso per gli esseri viventi.
Per raggiungere questo obiettivo, la miscela di rocce di terra viene trattata con una soluzione di solfato di zinco e carbonato di sodio a un pH di 7,5-9,0 e un composto xantato.
 Arsenopirita. Questo minerale dovrebbe essere separato dagli altri perché contiene arsenico tossico. La separazione può essere ottenuta con carbonato di zinco. James St. John/CC di (https: // creativeCommons.Org/licenze/by/2.0). Fonte: Wikimedia Commons.
Arsenopirita. Questo minerale dovrebbe essere separato dagli altri perché contiene arsenico tossico. La separazione può essere ottenuta con carbonato di zinco. James St. John/CC di (https: // creativeCommons.Org/licenze/by/2.0). Fonte: Wikimedia Commons. L'efficacia della formula è attribuita alla formazione di piccole particelle ZnCo3 Sulla superficie dell'arsenopirite che lo rende idrofilo (correlato all'acqua), quindi non è possibile aderire alle bolle d'aria e non può galleggiare, precipitare e separare dagli altri minerali.
Nel ottenere altri composti di zinco
Il carbonato di zinco è stato utilizzato per ottenere nanostrutture idrofobiche di borato di formula 3zno • 3b2O3• 3,5h2O. Questo materiale può essere usato come additivo ritardante di fiamma in polimeri, legno e tessuti.
Nel recupero dello zinco degli effluenti residui
Le ricche acque sintetiche su ioni di zinco scartati dai processi di elettrodeposizione possono essere trattate mediante tecnologia del letto fluidizzato usando carbonato di sodio per precipitare ZNCO3.
Può servirti: alcol secondario: cosa è, struttura, proprietà, usiQuando lo Zn precipita2+ Sotto forma di carbonato diminuisce la sua concentrazione, il solido ottenuto viene filtrato e le acque possono essere scartate in sicurezza. Lo Znco3 Il precipitato è alta purezza.
Altre app
Consente di preparare altri composti di zinco. È usato nei cosmetici. Funge da pigmento e viene utilizzato nella produzione di porcellana, ceramica e ceramica.
Rischi
Inalazione di polvere di Znco3 Può causare governante, tosse, torace, febbre e disagio sudorato. La sua ingestione produce nausea e vomito.
Effetti sull'ambiente
Il rischio principale è il suo effetto sull'ambiente, quindi dovrebbe essere evitato di essere sparso in questo. È molto tossico per la vita acquatica con conseguenze che durano negli organismi viventi.
Riferimenti
- O.S. Biblioteca nazionale di medicina. (2019). Carbonato di zinco. Recuperato da Pubchem.NCBI.Nlm.NIH.Gov.
- Piombo, d.R. (Editor) (2003). Manuale CRC di chimica e fisica. 85th CRC Press.
- Cotone, f. Albert e Wilkinson, Geoffrey. (1980). Chimica inorganica avanzata. Quarta edizione. John Wiley & Sons.
- Sharma, v. et al. (2018). Sintesi di nanoneedles di carbonato di zinco, al potenziale ritardante di fiamma per tessili di cotone. Cellulosio 25, 6191-6205 (2018). Link recuperato.Springer.com.
- Guan e. et al. (2020). ZnCo3 colloidale come potente depressivo di arsenopirite nella polpa debolmente alcalina e nel meccanismo di interazione. Minerali 2020, 10, 315. MDPI si è ripreso.com.
- Malattie della pelle, degli occhi, della congiuntiva e dell'orecchio esterno. (2017). In medicina veterinaria (undicesima edizione). Recuperato da ScienceDirect.com.
- Hannig, m. e Hannig, C. (2013). Nanobiomateriali in odontoiatria preventiva. In nanobiomateriali in odontoiatria clinica. Capitolo 8. Recuperato da ScienceDirect.com.
- Tugrul, n. et al. (2015). Sintesi di nanostrutture idrofobiche zinco a corto di zinco dal carbonato di zinco e caratterizzazione del prodotto. Res Chem Intermediate (2015) 41: 4395-4403. Link recuperato.Springer.com.
- Luna, m.D.G., et al. (2020). Recupero di granuli di zinco dalle acque reflue elettroplatori sintetiche mediante processo di cristallizzazione omogenea a tacchetta fluidizzata. Int. J. Ambiente. Sci. Technol. 17, 129-142 (2020). Link recuperato.Springer.com.
- « Caratteristiche di proposizioni particolari e universali
- Qual è il processo economico? Fasi ed esempi »

