Struttura del carbonato in alluminio, proprietà, usi
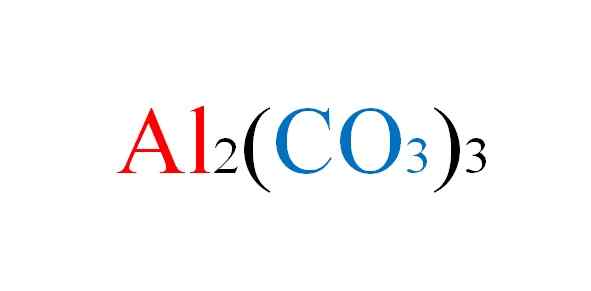
- 3207
- 873
- Baldassarre Ross
Lui Carbonato di alluminio È un sale inorganico la cui formula chimica è il2(CO3)3. È un carbonato metallico praticamente non esistente, data la sua elevata instabilità in condizioni normali.
Tra le ragioni della sua instabilità, possiamo menzionare le deboli interazioni elettrostatiche tra gli ioni a3+ e co32-, che in teoria dovrebbe essere molto forte per le magnitudini dei loro carichi.
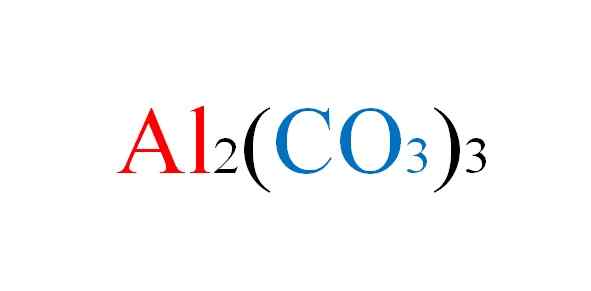 Formula di carbonato in alluminio. Fonte: Gabriel Bolívar.
Formula di carbonato in alluminio. Fonte: Gabriel Bolívar. Il sale affronta qualsiasi inconveniente nella carta quando vengono scritte le equazioni chimiche delle loro reazioni; Ma in pratica è contro di esso.
Nonostante ciò che è stato detto, il carbonato di alluminio può verificarsi in compagnia di altri ioni, come nel caso del minerale Dawsonite. C'è anche un derivato in cui interagisce con l'ammoniaca acquosa. Del resto, è considerato una miscela tra Al (OH)3 e h2Co3; che è uguale a una soluzione effervescente con un precipitato bianco.
Questa miscela ha usi medicinali. Tuttavia, al sale puro, isolabile e manipolabile di Al2(CO3)3, Non sei noto possibili applicazioni; Almeno non basse pressioni enormi o condizioni estreme.
[TOC]
Struttura del carbonato in alluminio
La struttura cristallina per questo sale è sconosciuta, perché è così instabile che non è stato in grado di essere caratterizzato. Dalla sua formula a2(CO3)3, Tuttavia, è noto che la proporzione di ioni al3+ e co32- È 2: 3; Questo per dire che per ogni due cationi al2+ Ci devono essere tre anioni co32- interagendo elettrostaticamente con loro.
Il problema è che entrambi gli ioni sono molto ineguali per quanto riguarda le loro dimensioni; Al3+ È molto piccolo mentre il CO32- È voluminoso. Questa differenza da sola influisce già sulla stabilità reticolare della rete cristallina, i cui ioni interagiscono "goffamente" se questo sale in stato solido fosse isolato.
Può servirti: numero Avogadro: cronologia, unità, come viene calcolato, usiOltre a questo aspetto, Al3+ È una proprietà altamente polarizzante, che deforma la nuvola elettronica del CO32-. È come se volesse costringerlo a collegarlo in modo covalente, anche se l'anione non può farlo.
Di conseguenza, interazioni ioniche tra Al3+ e co32- Tendono verso la covalenza; Un altro fattore che si aggiunge all'instabilità di Al2(CO3)3.
Idrossido carbonato in alluminio ammonio
La relazione caotica tra Al3+ e co32- Si ammorbidisce quando ci sono altri ioni presenti nel vetro; come NH4+ e oh-, Da una soluzione di ammoniaca. Questo quartetto ionico, al3+, Co32-, NH4+ e oh-, Riescono a definire cristalli stabili, anche in grado di adottare morfologie diverse.
Un altro esempio simile a questo è osservato nel minerale Dawsonite e nei suoi cristalli ortorrombici, Naalco3(OH)2, Dove il na+ Sostituire NH4+. In questi sali i loro legami ionici sono abbastanza forti in modo che l'acqua non promuova il rilascio di CO2; o almeno non bruscamente.
Sebbene il NH4Al (Oh)2Co3 (Aacc, per i suoi sigle in inglese), né il naalco3(OH)2 Rappresentano carbonato di alluminio, possono essere considerati derivati di base dello stesso.
Proprietà
Massa molare
233,98 g/mol.
Instabilità
Nella sezione precedente è stato spiegato da una prospettiva molecolare perché al2(CO3)3 È instabile. Ma quale trasformazione soffre? Devi considerare due situazioni: una secca e l'altra "bagnata".
Asciutto
Nella situazione secca, l'anione co32- CO è invertito2 Attraverso la seguente decomposizione:
Al2(CO3)3 => Al2O3 + 3co2
Può servirti: fosfato di calcio (CA3 (PO4) 2)Il che ha senso se viene sintetizzato in allumina a grandi pressioni di CO2; Cioè, la reazione inversa:
Al2O3 + 3co2 => Al2(CO3)3
Pertanto, per evitare di decomposizione dell'AL2(CO3)3 Dovresti inviare sale a grandi pressioni (usando N2, Per esempio). In questo modo la formazione di CO2 non sarebbe termodinamicamente favorito.
Bagnato
Mentre nella situazione bagnata, il CO32- Soffre di idrolisi, che genera piccole quantità di OH-; Ma abbastanza per far precipitare l'idrossido di alluminio, a (OH)3:
Co32- + H2O HCO3- + OH-
Al3+ + 3oh- Al (Oh)3
E d'altra parte, l'AL3+ È anche idrolizzato:
Al3+ + H2O a (oh)22+ + H+
Anche se sarebbe davvero idratato3+ Per formare il complesso a (h2O)63+, che è idrolizzato da dare [a (h2O)5OH]2+ e h3O+. Quindi, h3O (o h+) Protona a co32- a h2Co3, che si rompe a co2 e h2O:
Co32- + 2h+ => H2Co3
H2Co3 Co2 + H2O
Si noti che alla fine l'AL3+ Si comporta come un acido (rilascio h+) e una base (rilascio oh- Con l'equilibrio della solubilità di Al (OH)3); Cioè, mostra l'anfoterismo.
Fisico
Per essere in grado di isolarsi, è probabile che questo sale sia bianco, come molti altri sali di alluminio. Inoltre, a causa della differenza tra le radio ioniche di Al3+ e co32-, Sicuramente avrebbe punti di fusione o bollitura molto bassi rispetto ad altri composti ionici.
Può servirti: Benchilo: benzil idrogeni, carbocazioni, radicali benziliciE per quanto riguarda la sua solubilità, sarebbe infinitamente solubile in acqua. Inoltre, sarebbe un solido igroscopico e delizioso. Tuttavia, queste sono solo congetture. Altre proprietà dovrebbero essere stimate con i modelli di calcolo soggetti ad alte pressioni.
Applicazioni
Le applicazioni note dal carbonato di alluminio sono mediche. È stato usato come astringente morbido e come farmaco per trattare l'infiammazione e l'ulcera gastrica. È stato anche usato per prevenire la formazione di calcoli urinari nell'uomo.
È stato usato per controllare un aumento del contenuto corporeo del fosfato e anche per trattare i sintomi dell'acidità dello stomaco, l'indigestione acida e le ulcere allo stomaco.
Riferimenti
- Xuehui l., Zhe t., Yongming c., Ruiyu z. & Chenguang l. (2012). Sintesi idrotermale di nanoplatelet e nanofibre di nanoplatelet e nanofibre di nanoplatelet e nanofibre di nanofibre. Atlantis Press.
- Robin Lafficher, Mathieu Digne, Fabien Salvatori, Malika Boualleg, Didier Colson, Francois Puel (2017) Ammonio Alumino Carbonate Hydrosside NH4al (OH) 2Co3 come percorso alternativo per la preparazione dell'alluminio: confronto con il classico precursore boehmite boehmite. Powder Technology, 320, 565-573, doi: 10.1016/j.Powec.2017.07.0080
- Centro nazionale per le informazioni sulla biotecnologia. (2019). Carbonato di alluminio. Database PubChem., CID = 1035396. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov
- Wikipedia. (2019). Carbonato di alluminio. Recuperato da: in.Wikipedia.org
- Aluminuminumsulfato. (2019). Carbonato di alluminio. Recuperato da: alluminumumsulfato.netto

