Formazione di carbocalizzazione, caratteristiche, tipi, stabilità
- 676
- 27
- Lidia Valentini
UN Carbocalizzazione, Come suggerisce il nome, è uno ione organico che ha un atomo di carbonio caricato positivamente, che è caratterizzato dall'essere altamente instabile, esistente per un breve periodo. Di solito è un intermediario nelle reazioni organiche, cioè originata come passaggi indispensabili dei rispettivi meccanismi molecolari.
Storicamente ci sono stati punti di conflitto nella compressione di ciò che è il carbocalizzazione. Questo perché ci sono sinfine di molecole reattive che, per un motivo o nell'altro, acquisiscono un carico positivo in uno dei loro carboni. Il carbocalizzazione classica, per così dire, è uno che può essere rappresentato dalla formula generale dell'immagine sottostante.
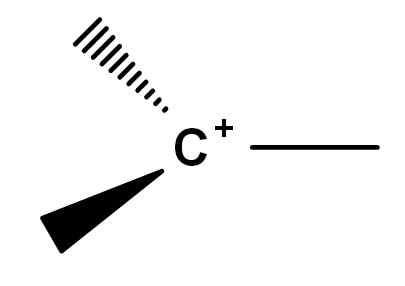 Formula generale di un carbocalizzazione. Fonte: Gabriel Bolívar.
Formula generale di un carbocalizzazione. Fonte: Gabriel Bolívar. Nota come il carico positivo si trova esattamente sull'atomo di carbonio e manca anche di un collegamento. Pertanto, il carbocalizzazione è povero elettroni, questa è la causa della sua elevata reattività.
Supponiamo metano, Cho4. Se il carbonio avesse perso uno dei suoi atomi di idrogeno, elimineremmo uno dei quattro legami C-H. Quindi ha avuto origine la carbocalizzazione metilica, CH3+, che potremmo rappresentare semplicemente posizionando gli atomi di idrogeno alle estremità delle strisce della formula superiore. Il ch3+ È il più semplice di tutte le carbocazioni.
[TOC]
Formazione
Come si formano le carbocazioni? La risposta si trova nei meccanismi di reazioni. Tuttavia, la stragrande maggioranza in comune uno dei seguenti due aspetti:
-Rottura eterolitica
-Aggiunta di elettroni π a un elettrofilo
Rottura eterolitica
Nella rottura eterolitica il legame C-G, essendo qualsiasi atomo o gruppo, è rotto in modo ineguale: gli elettroni del legame vengono lasciati G, mentre l'atomo di carbonio acquisisce un carico positivo. Per esempio:
Può servirti: arsenico: storia, struttura, proprietà, usi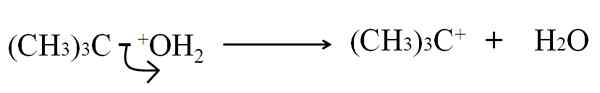 Rottura eterolitica nella disidratazione del tertbutanolo. Fonte: Gabriel Bolívar.
Rottura eterolitica nella disidratazione del tertbutanolo. Fonte: Gabriel Bolívar. Ora, questa pausa può essere data per diversi metodi, che a loro volta cambieranno il meccanismo e la reazione considerata.
Aggiunta di elettroni π a un elettrofilo
L'altro processo mediante il quale si forma un carbocalizzazione, essendo molto comune negli alcheni e nei composti aromatici, è attaccare gli elettroni di un doppio legame con un elettrofilo. I casi più comuni sono l'idrogenazione degli alcheni mediante l'azione di un acido:
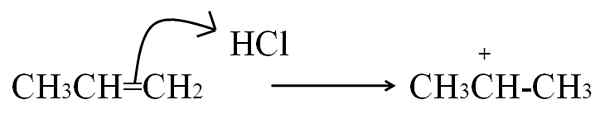 Reazione HCL con il propeno per formare un carbocalizzazione come intermediario. Fonte: Gabriel Bolívar.
Reazione HCL con il propeno per formare un carbocalizzazione come intermediario. Fonte: Gabriel Bolívar. Questa equazione corrisponde alla formazione di carbocalizzazione, che è un procacciatore d'affari, Non un prodotto. Gli elettroni a doppio legame attaccano l'idrogeno HCl, l'elettrofilo. L'idrogeno viene aggiunto al carbonio a destra del doppio legame, quindi si forma il gruppo -CH3, Mentre il carbonio a sinistra acquisisce il carico positivo.
Caratteristiche
Ibridazione
La formula generale presentata all'inizio rivela una geometria piatta trigonale attorno all'atomo di carbonio. Ciò è dovuto all'ibridazione subita dagli orbitali atomici di carbonio per diventare orbitali ibridi2, che sono separati con un angolo di 120º. Sebbene non sia rappresentato, il carbocalizzazione ha un orbitale P Puro e vuoto, in grado di accettare elettroni.
Acidità
Il carbocalizzazione è una specie acida, secondo la definizione di Brönsted o Lewis. La loro carica positiva richiede elettroni o atomi di idrogeno che vengono somministrati. È per questo motivo che le carbocazioni non possono essere formate in media molto basilari, poiché reagirebbero immediatamente per originare altri prodotti.
Stabilità
L'ibridazione sp2 di carbocalizzazione lo rende vulnerabile agli attacchi di specie ricche negli elettroni. Questa funzione è ulteriormente accentuata dalla sua grande acidità. Di conseguenza, il carbocalizzazione è una specie molto reattiva, che non si è formata e presto (in una questione di nanosecondi) reagisce per dare origine al vero prodotto della reazione chimica.
Può servirti: acido solfamico: struttura, proprietà, sintesi, usiTipi di carbocazioni
Esistono diversi tipi di carbocazioni. Tuttavia, questi possono essere classificati come segue:
-Primario
-Secondario
-Terziario
-Aromatico o arillos
-Vinile e alilico
Primario
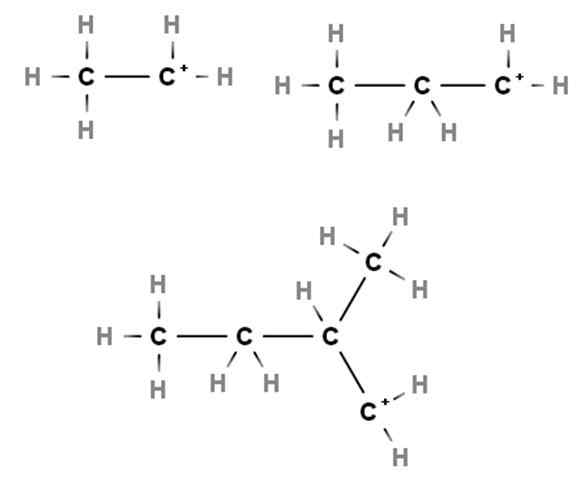 Carbocazioni primarie. Fonte: Gabriel Bolívar via Molview.
Carbocazioni primarie. Fonte: Gabriel Bolívar via Molview. Gli arrivi mostrano esempi di carbocazioni primarie. Si chiamano perché il carico positivo risiede in un carbonio primario, 1 °, quindi è collegato solo a un atomo di carbonio. Etano, ch3Cap3, Quando A H perde una delle sue estremità, Carbocation Cho3Cap2+ O +Cap2Cap3.
Secondario
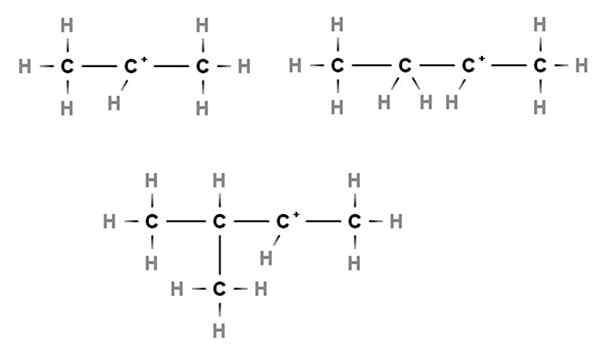 Carbocazioni secondarie. Fonte: Gabriel Bolívar via Molview.
Carbocazioni secondarie. Fonte: Gabriel Bolívar via Molview. Nelle carbocazioni secondarie, il carico positivo si trova in un carbonio secondario, 2 °, che è collegato a due atomi di carbonio. Ad esempio, se il propano, Cho3Cap2Cap3, Portiamo via una H del carbonio centrale, avremo il carbocalizzazione Cho3Cap2+Cap3.
Terziario
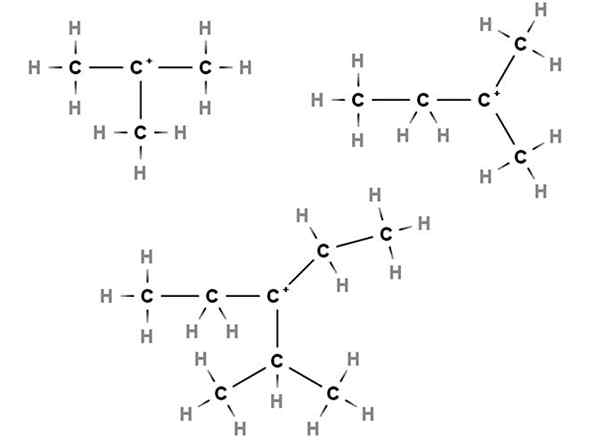 Carbocazioni terziarie. Fonte: Gabriel Bolívar via Molview.
Carbocazioni terziarie. Fonte: Gabriel Bolívar via Molview. Nelle carbocazioni terziarie il carico positivo si trova in un carbonio terziario, 3 °, collegato a tre atomi di carbonio. Si noti che, a differenza dei primi due tipi di carbocazioni, mancano di atomi di idrogeno.
Pertanto, abbiamo metilpropano o isobutano, CH (CH (scegli3)3, Che perdendo un idrogeno il carbonio centrale forma il carbocalizzazione +C (Ch3)3.
Aromatico
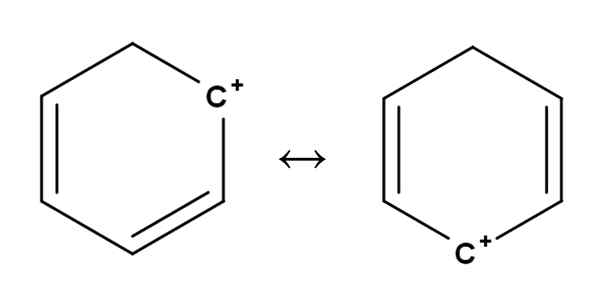 Benzene Carbocat. Fonte: Gabriel Bolívar.
Benzene Carbocat. Fonte: Gabriel Bolívar. Le carbocazioni aromatiche o aromatiche sono forse le più speciali di tutte. La tua formazione è molto simile a quella descritta per gli alcheni nella prima sezione.
In essi, il carico positivo si trova, in linea di principio, in uno dei carboni di un anello aromatico, come il benzene. Tuttavia, il carico positivo non è fisso, ma è disperso in altre posizioni dell'anello per risonanza.
Può servirti: ribulosa-1,5-bifosfato (RUBP): caratteristiche, carbolixationEcco come il carico positivo, come visto sopra, passa da un carbonio all'altro all'interno dell'anello del benzene. Questa caratteristica dà a questa carbocazione una grande stabilità contro gli altri tipi di carbocazioni.
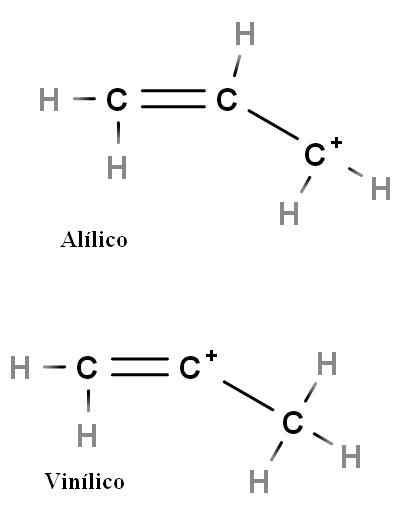
Allilico e vinile
 Carbocalizzazione allilica e vinile. Fonte: Gabriel Bolívar.
Carbocalizzazione allilica e vinile. Fonte: Gabriel Bolívar. Altri tipi speciali di carbocazioni sono alilici e vinilici. La differenza tra loro (sopra) è la posizione della carica positiva correlata al doppio legame.
Nel carbocalizzazione in vinile il carico positivo si trova in uno dei carboni a doppio legame; Mentre è in carbocalizzazione alteica, il carico positivo si trova nel carbonio seguendo il doppio legame. È sufficiente sostituire gli idrogeni con altri gruppi e avremo una grande famiglia di carbocazioni alteiche e in vinile.
Stabilità relativa
Sapendo quali sono i principali tipi di carbocazioni, possono essere ordinati in base alla loro stabilità relativa:
Vinile < Primario < Secundario < Alílico < Terciario < Aromático
Ora, potrebbero esserci carbocazioni Allic che sono più stabili di un terziario specifico. Tutto dipenderà dai loro sostituenti.
Perché questa stabilità? Alla capacità della molecola di disperdere o ridurre il carico positivo del carbocalizzazione. Per fare ciò, sono necessari atomi ravvicinati che danno parte della sua densità di carbocalizzazione elettronica mediante iperconjugation. Nel frattempo, nelle carbocazioni allumiche e aromatiche questo è ottenuto per risonanza.
Nel caso del carbocalizzazione in vinile, il carico positivo si trova su un carbonio che era già SP2, Il che lo rende molto instabile.
Riferimenti
- Graham Solomons t.W., Craig b. Frigorifero. (2011). Chimica organica. (10th Edizione.). Wiley Plus.
- Carey f. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Morrison e Boyd. (1987). Chimica organica. (Quinta edizione). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Carbocalizzazione. Recuperato da: in.Wikipedia.org
- James Ashenhurst. (20 febbraio 2020). 3 fattori che stabilizzano le carbocazioni. Recuperato da: MasterOrganicChemistry.com
- Clark Jim. (2000). Carbocations (o ioni del carbonium). Recuperato da: ChemGuide.co.UK
- Dottore. Kennepohl, prof. S. Agricoltore & t. Soderberg. (10 agosto 2020). Struttura e stabilità del carbocalizzazione. Chimica librettexts. Recuperato da: Chem.Librettexts.org
- « Concetto, caratteristiche ed esempi dei codici etici ambientali
- Le 4 stazioni dell'anno in Messico e le sue caratteristiche »

