Calore a combustione

- 4954
- 1086
- Ruth Cattaneo
Qual è il calore della combustione?
Lui Calore a combustione È l'energia rilasciata quando una certa quantità di materiale, di solito una mol, reagisce esotermicamente con l'ossigeno dell'aria. È una proprietà termochimica essenziale nella caratterizzazione di carburanti, alcoli e, in particolare, idrocarburi, come butano e metano.
Quando una sostanza brucia luce e calore, l'energia che può essere utilizzata per lavorare su altri corpi. Ad esempio, il calore generato è in grado di riscaldare grandi volumi d'acqua, il cui vapore preme l'ambiente circostante, agendo alcuni generatori elettrici; o semplicemente, riscaldando ulteriormente cibi al vapore.
 Il calore generato dalla combustione del gas da cucina viene utilizzato per riscaldare i calderoni e il cibo
Il calore generato dalla combustione del gas da cucina viene utilizzato per riscaldare i calderoni e il cibo Il calore della combustione varia tra tutte le sostanze, anche se la sua natura chimica è essenzialmente la stessa. Questa variazione corrisponde alla stabilità relativa, cioè: più instabile un composto, maggiore è l'energia rilasciata, rappresentata come -ΔH. Il simbolo negativo significa che il calore scorre.
Diversi valori -ΔH vengono utilizzati per confrontare la stabilità relativa tra alkaus diversi e i loro isomeri. Gli consente anche di essere stabile.
Misurazione
Per misurare i riscaldamenti a combustione, è necessaria una pompa calorimetrica. All'interno di essa la sostanza sta reagendo con ossigeno mediante l'attivazione di una scintilla elettrica.
Quindi, il calore rilasciato riscalda un volume di acqua che circonda il compartimento del campione, misurando la temperatura prima e dopo la combustione, nonché la massa di acqua e carburante.
Quindi, l'energia rilasciata sarà uguale a:
Ceh2o·MH2O · Δt
Doveeh2o È il calore specifico dell'acqua, 4.184 J/G · ºC, MH2O la massa dell'acqua e Δt il suo cambiamento di temperatura. Infine, questo calore, espresso in unità di joule o calorie, è diviso tra la massa o le moli del carburante collocato all'interno della pompa calorimetrica, per ottenere il calore di combustione per unità di massa o moli.
Può servirti: qual è l'equivalente meccanico del calore?I metalli non si combinano, ma si ossidano a velocità diverse a seconda della temperatura in cui sono esposti. Il calore che producono è spregevole da essere misurati allo stesso modo in cui è fatto con idrocarburi e altri carburanti. Non sono quindi sostanze combustibili.
Potenziali energie
Durante la combustione i collegamenti sono rotti per formarne di nuovi, più stabili. L'energia contenuta in tutti i collegamenti molecole è indipendente dal suo movimento, quindi c'è una potenziale energia.
Maggiore è l'energia potenziale, più instabile sarà la molecola e, quindi, rilascerà più calore una volta stabiliti i nuovi collegamenti.
Per sapere quali sono esattamente questi nuovi collegamenti, dovrebbero essere considerati i prodotti di una combustione completa: CO2 Per carbonio, h2O per idrogeno e non2 Per azoto. Per quanto riguarda gli idrocarburi, la loro completa combustione genererà miscele stechiometriche di CO2 e h2O.
Entrambe le molecole, CO2 e h2Oppure, hanno energie potenziali molto basse, perché i loro collegamenti (O = C = O e H-O-H) sono molto stabili rispetto ai collegamenti di idrocarburi da cui provenivano (C-H e C-C).
Stabilità relativa
Le potenziali energie sono liberamente. Ma le loro variazioni non sono, cioè la differenza di quelle energie tra i prodotti (CO2 e h2O) e reagenti (idrocarburi).
Ecco perché avere queste variazioni, o cosa sia la stessa, i loro calcoli a combustione, puoi sapere quali sono la stabilità relativa tra un insieme di idrocarburi o isomeri.
Chiude
Gli alcani possono essere lineari, ramificati o ciclici. Nel caso degli alcani lineari, il suo calore di combustione varia a seconda della lunghezza delle sue catene; cioè, dipende da quante unità ch2 Avere. Considera l'esempio di N-esano, N-Eptano e N-ottano:
Può servirti: iodio: storia, proprietà, struttura, ottenimento, rischi, usiCap3(Ch2)4Cap3, -ΔH = 4163 kJ/mol
Cap3(Ch2)5Cap3, -ΔH = 4817 kJ/mol
Cap3(Ch2)6Cap3, -ΔH = 5471 kJ/mol
Puoi vedere che i suoi calcoli a combustione variano di 654 kJ/mol. Ciò significa che ogni Cho2 che viene aggiunto alla catena aumenta il calore della combustione ad una velocità di 654 kJ/mol. Quindi, il nonno, ch3(Ch2)7Cap3, Avrà un calore a combustione pari a 6125 kJ/mol (5471 kJ/mol + 654 kJ/mol).
Questo è lo stesso di dire che le catene più lunghe hanno maggiori energie potenziali e quindi sono più instabili.
Gli alcani ramificati sono più stabili che lineari, e questo è dedotto dai loro calcoli a combustione. Considera ora il caso di tre isomeri dell'ottano:
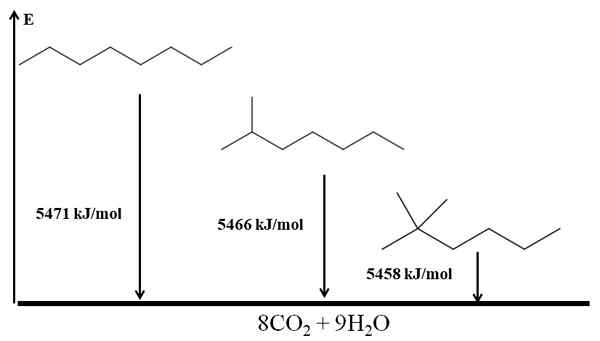 Custice di combustione per tre isomeri di ottano. Fonte: Gabriel Bolívar via Molview.
Custice di combustione per tre isomeri di ottano. Fonte: Gabriel Bolívar via Molview. Lui N-Octano è il più instabile perché il suo calore di combustione è il più grande (5471 kJ/mol). D'altra parte, gli isomeri 2-metilheptano e 2.2-dimetilhexan. Il 2.2-dimetilhexan è il più stabile per essere il più ramificato dei tre isomeri.
Alcheni
La stabilità relativa degli alcheni può anche essere ottenuta dai loro calcoli a combustione. Considera, ad esempio, quattro isomeri Butenus:
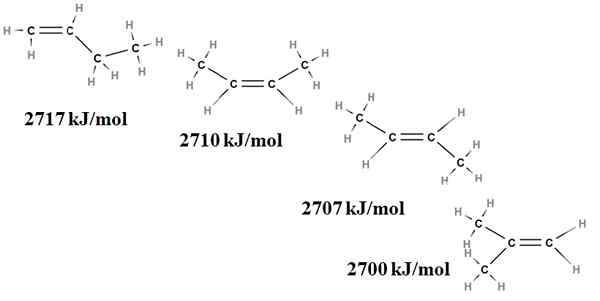 Custice di combustione per gli isomeri di buteno. Fonte: Gabriel Bolívar via Molview.
Custice di combustione per gli isomeri di buteno. Fonte: Gabriel Bolívar via Molview. Qui non parliamo più di ramificazioni, ma del grado di sostituzione del doppio legame, C = C, e delle sue tensioni di van der Waals; cioè, di repulsioni elettroniche e steriche tra due gruppi voluminosi situati sullo stesso lato del doppio legame.
Il primo isomero, 1-butene, è il più instabile perché il suo doppio legame è meno sostituito (h2C = c). Ciò si riflette nel suo calore di combustione di 2717 kJ/mol.
Può servirti: acido clorogenicoA destra, il cis-2-butene, è un po 'più stabile perché il suo doppio legame è più sostituito. Ma il trans-2-butene lo è ancora di più, perché anche se ha lo stesso grado di sostituzione, i gruppi scelgono3 del doppio legame sono in posizioni trans, cioè su diversi lati del doppio legame. Si noti che il calore del trans-2-butene (2707 kJ/mol) è appena un po 'più basso di quello del cis-2-butene (2710 kJ/mol).
L'ultimo isomero, il 2-metil-2-butene, che è anche sostituito come cis e trans 2 bungeo, è comunque il più instabile di tutti. Questo perché entrambi CH3 Si trovano in uno dei carboni del doppio legame, quindi essendo un alchene con Cho3 Geminali.
Composti carbonilici
Oltre agli alcos e ad altri idrocarburi in generale, la relativa stabilità dei composti carbonilici (chetoni, aldeidi, acidi carbossilici) sono anche correlati ai loro riscaldamenti a combustione.
Pertanto, più stabilizzati o meno reattivi i loro gruppi c = o, i minori saranno i loro caldi a combustione.
Ad esempio, il calore della combustione del butano, CH3Cap2Cap2Cho, è 2475 kJ/mol. Questo calore è superiore al 2-butanone, ch3Cap2Coch3, che è uguale a 2442 kJ/mol. Pertanto, budiale è più instabile del 2-butanone.
Nel 2-butanone il c = o è più stabilizzato grazie ai gruppi CH3Cap2 e ch3; Cosa che non accade con il butan, in cui uno dei gruppi è a malapena un atomo h.
Riferimenti
- Morrison, r. T. e Boyd, r, n. (1987). Chimica organica. 5a edizione. Editoriale Addison-Wesley Inter-American.
- Carey f. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Graham Solomons t.W., Craig b. Frigorifero. (2011). Chimica organica. (10a edizione.). Wiley Plus.
- Wikipedia. (2020). Calore di combustione. Recuperato da: in.Wikipedia.org
- Fondazione CK-12. Calore di combustione. Chimica librettexts. Recuperato da: Chem.Librettexts.org
- BBC. (2020). Energia chimica: entalpia di combustione. Estratto da: BBC.co.UK
- Steven a. Hardinger. (2017). Glossario illustrato della chimica organica: entalpia della combustione. Recuperato da: Chem.Ucla.Edu

