Formule di calore ceped, come calcolarlo e risolvere esercizi

- 1976
- 151
- Zelida Gatti
Lui Calore ceduto È il trasferimento di energia tra due corpi a temperature diverse. Quello che è una temperatura più alta dà calore a quello la cui temperatura è inferiore. Se un corpo produce o assorbe il calore, la sua temperatura o le sue condizioni fisiche possono variare a seconda della massa e delle caratteristiche del materiale di cui è realizzato.
Un buon esempio è in una tazza di caffè fumante. Il cucchiaio di metallo con cui lo zucchero viene mescolato. Se viene lasciato all'interno della tazza abbastanza tempo, il caffè e il cucchiaino di metallo finiranno. Un po 'di calore sarà passato all'ambiente, poiché il sistema non è isolato.
 Il caffè e il cucchiaino diventano in equilibrio termico per un po '. Fonte: Pixabay.
Il caffè e il cucchiaino diventano in equilibrio termico per un po '. Fonte: Pixabay. Quando le temperature sono abbinate, il equilibrio termale.
Se lo stesso test fosse fatto con un cucchiaino di plastica, si accarerebbe sicuramente che non si riscalda velocemente come il metallo, ma alla fine diventerà anche in equilibrio con il caffè e tutto ciò che lo circonda.
Questo perché il metallo conduce il calore meglio della plastica. D'altra parte, sicuramente il caffè dà calore a un ritmo diverso rispetto alla cioccolata calda o ad altri bevande. Quindi, il calore assegnato o assorbito da ciascun oggetto dipende dal materiale o dalla sostanza.
[TOC]
Cosa è e formule
Il calore si riferisce sempre al flusso o al transito di energia tra un oggetto e un altro, a causa della differenza di temperatura.
Ecco perché si parla di calore di calore assegnato o assorbito, poiché aggiungendo o estraendo calore o energia in qualche modo, è possibile modificare la temperatura di un elemento.
Di solito è chiamato la quantità di calore che l'oggetto più caldo produce. Questo valore è proporzionale alla massa di detto oggetto. Un corpo con grande massa è in grado di rinunciare a più calore di un'altra di massa minore.
Può servirti: Millikan Experiment: procedura, spiegazione, importanzaLa differenza di temperatura Δt
Un altro fattore importante nel calcolo del calore assegnato è la differenza di temperatura che l'oggetto che produce il calore sperimenta. È indicato come ΔT Ed è calcolato in questo modo:
ΔT = TF - TO
Infine, la quantità di calore assegnata dipende anche dalla natura e dalle caratteristiche dell'oggetto, che sono riassunti quantitativamente in una costante chiamata Calore di calore specifico, indicato come C.
Quindi, infine, l'espressione per il calore assegnato è la seguente:
QScarsamente = - m.C.ΔT
La resa è simboleggiata con un segno negativo.
La capacità di calore e calore specifica di una sostanza
Il calore specifico è la quantità di calore necessario per aumentare la temperatura di 1 g di sostanza di 1 ° C. È una proprietà intrinseca del materiale. Le sue unità nel sistema internazionale sono: joule/kg . K (Joule tra il chilogrammo X temperatura in gradi Kelvin).
La capacità termica C è un concetto collegato, ma leggermente diverso, poiché intervenisce la massa dell'oggetto. La capacità termica è definita come segue:
C = MC
Le sue unità in s.Yo. Sono joule/k. In modo che il calore ceduto possa anche essere espresso equivalentemente come:
Q = -c. ΔT
Come calcolarlo?
Per calcolare il calore assegnato da un oggetto, è necessario conoscere quanto segue:
- Il calore specifico della sostanza che dà il calore.
- La massa di detta sostanza
- La temperatura finale da ottenere
I valori termici specifici per molti materiali sono stati determinati sperimentalmente e sono disponibili nelle tabelle.
Calorimetria
Ora, se questo valore non è noto, è possibile ottenerlo con l'aiuto di un termometro e acqua in un contenitore termicamente isolato: il calorimetro. Uno schema di questo dispositivo è mostrato nella figura che accompagna l'esercizio 1.
Un campione della sostanza è immerso a una certa temperatura in una quantità di acqua che ha precedentemente misurato. Viene misurata la temperatura finale e con i valori ottenuti il calore specifico del materiale.
Può servirti: errore casuale: formula ed equazioni, calcolo, esempi, eserciziConfrontando il risultato con valori tabulati, si può sapere di che sostanza sia. Questa procedura è chiamata calorimetria.
L'equilibrio termico viene effettuato dalla conservazione dell'energia:
Q Scarsamente + Q assorbito = 0
Esercizi risolti
Esercizio 1
Un pezzo 0 di 0.35 kg a una temperatura di 150 ºC in 500 ml di acqua a una temperatura di 25 º C. Trovare:
a) La temperatura di equilibrio finale
b) quanta calore scorre in questo processo?
Dati
Crame = 385 J/kg . ºC
Cacqua = 4180 J/kg . ºC
Densità dell'acqua: 1000 kg/m3
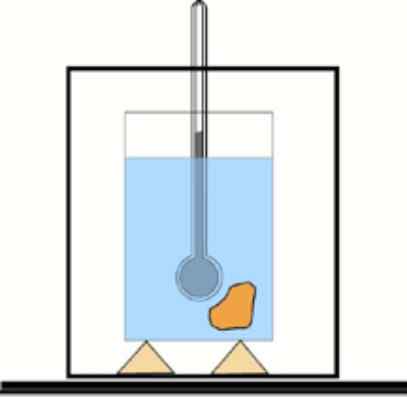 Schema di calorimetro di base: un contenitore con acqua isolata e un termometro per misurare le variazioni di temperatura. Lfiente: dr. Tilahun Tesfaye [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]
Schema di calorimetro di base: un contenitore con acqua isolata e un termometro per misurare le variazioni di temperatura. Lfiente: dr. Tilahun Tesfaye [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)] Soluzione
a) Il rame dà calore mentre l'acqua lo assorbe. Poiché il sistema è considerato chiuso, solo l'acqua e il campione intervengono nel bilanciamento del calore:
Q Scarsamente = Q assorbito
D'altra parte, è necessario calcolare la massa di 500 ml di acqua:
500 ml = 0.5 l = 0.0005 m3
Con questi dati viene calcolata la massa dell'acqua:
massa = densità x volume = 1000 kg/m3 . 0.0005 m3 = 0.5 kg
L'equazione di calore è sollevata in ogni sostanza:
QScarsamente = -mrame . Crame. ΔT = -0.35 kg . 385 J/kg .ºC . (TF -150 ºC) = -134.75 (tF - 150) J
Qassorbito = macqua . Cacqua. ΔT = 0.5 kg . 4186 J/kg . ºC .(TF -25 ºC) = 2093 (tF -25) J
Equalizzare i risultati che hai:
2093 (tF - 25) = -134.75 (tF - 150)
È un'equazione lineare con uno sconosciuto, la cui soluzione è:
TF = 32.56 ºC
b) La quantità di calore che scorre è il calore assegnato o il calore assorbito:
Q Scarsamente = - 134.75 (32.56 - 150) J = 15823 J
Q assorbito = 2093 (32.56 - 25) J = 15823 J
Esercizio 2
Un pezzo di rame da 100 g viene riscaldato in un forno a una temperatura tO E poi viene introdotto in un calorimetro di rame di 15 g che contiene 200 g di acqua a 16 º C. La temperatura finale una volta in equilibrio è di 38 º C. Quando il calorimetro e il suo contenuto vengono pesati, si scopre che sono evaporati.2 g di acqua qual era la temperatura iniziale tO?
Può servirti: worm hole: storia, teoria, tipi, formazioneDati: il calore latente della vaporizzazione dell'acqua è lv = 2257 kJ/kg
Soluzione
Questo esercizio differisce dal precedente, poiché si deve considerare che il calorimetro assorbe anche il calore. Il calore assegnato dal pezzo di rame è investito in tutte le seguenti:
- Scaldare l'acqua dal calorimetro (200 g)
- Scalda il rame di cui è realizzato il calorimetro (150 g)
- Evaporare 1.2 grammi di acqua (per un cambiamento di fase hai anche bisogno di energia).
QScarsamente = -100 X 1 x 10 -3 kg. 385 J/kg . ºC. (38 - tO ) ºC = -38.5. (38 - tO) J
Q assorbito da lui calorimetro = Q assorbito dall'acqua + Q vaporizzazione + Q assorbito dal rame
0.2 kg .4186 J/kg ºC .(38 - 16 ºC) + 1.2 x 10-3 kg. 2257000 J/kg +0.150 kg .385 J/kg .ºC.(38 - 16 ºC) =
18418.4 +2708.4 + 1270.5 J = 22397.3 j
Perciò:
-38.5. (38 - tO) = 22397.3
TO = 619.7 ºC
Il calore necessario per trasportare l'1 avrebbe potuto essere considerato.2 g di acqua fino a 100 º C, ma è una quantità abbastanza piccola rispetto.
Riferimenti
- Giancoli, d. 2006. Fisica: principi con applicazioni. 6th. Ed. Prentice Hall. 400 - 410.
- Kirkpatrick, l. 2007. Fisica: uno sguardo al mondo. 6ta Edizione abbreviata. Apprendimento del Cengage. 156 - 164.
- Rex, a. 2011. Fondamenti di fisica. Pearson. 309 - 332.
- Sears, Zemansky. 2016. Fisica universitaria con fisica moderna. 14th. Ed. Volume 1. 556 - 553.
- Serway, r., Vulle, c. 2011. Fondamenti di fisica. 9n / a Apprendimento del Cengage.
- « Concetto di calore sensibile, formule ed esercizi risolti
- Definizione, formule ed esercizi per rig fattoriali »

