Formule assorbite dal calore, come calcolarlo e risolvere esercizi

- 1251
- 237
- Rufo Longo
Lui calore assorbito È definito come il trasferimento di energia tra due corpi a temperature diverse. Quello con temperatura inferiore assorbe il calore rispetto a una temperatura più alta. Quando ciò accade, l'energia termica della sostanza che assorbe il calore aumenta e le particelle che lo compongono vibrano più rapidamente, aumentando la sua energia cinetica.
Questo può tradursi in un aumento della temperatura o di un cambio di stato. Ad esempio, spostati dal solido al liquido, come il ghiaccio quando si scioglie in contatto con acqua o soda a temperatura ambiente.
 Il cucchiaino di metallo assorbe il calore del caffè caldo. Fonte: Pixabay.
Il cucchiaino di metallo assorbe il calore del caffè caldo. Fonte: Pixabay. Grazie al calore, è anche possibile che gli oggetti cambino le loro dimensioni. La dilatazione termica è un buon esempio di questo fenomeno. Quando la maggior parte delle sostanze viene riscaldata, di solito sperimentano un aumento delle loro dimensioni.
Un'eccezione a questo è l'acqua. La stessa quantità di acqua liquida aumenta il suo volume quando raffreddata al di sotto di 4 ºC. Inoltre, le variazioni di temperatura possono anche sperimentare cambiamenti a livello della loro densità, qualcosa anche molto osservabile nel caso dell'acqua.
[TOC]
Cosa è e formule
In caso di energia durante il transito, le unità del calore assorbite sono le joule. Tuttavia, per molto tempo il caldo aveva le sue unità: le calorie.
Ancora oggi questa unità viene utilizzata per quantificare il contenuto energetico del cibo, sebbene in realtà una caloria alimentare corrisponda a un chilocalory di calore.
Calorie
Le calorie, abbreviate come lime, È la quantità di calore necessaria per aumentare la temperatura di 1 grammo di acqua di 1 º C.
Nel diciannovesimo secolo, Sir James Prescott Joule (1818-1889) conduceva un famoso esperimento in cui riuscì a trasformare il lavoro meccanico in calore, ottenendo la seguente equivalenza:
1 calorie = 4.186 Joules
Nelle unità britanniche, l'unità di calore si chiama BTU (Unità termica britannica), che è definito come la quantità di calore necessaria per aumentare la temperatura di una libbra di acqua in 1 ºF.
Può servirti: curva di calibrazione: a cosa serve, come farlo, esempiL'equivalenza tra le unità è la seguente:
1 Btu = 252 calorie
Il problema con queste vecchie unità è che la quantità di calore dipende dalla temperatura. Cioè, non è lo stesso che è necessario passare da 70 ºC a 75 ° C rispetto a quello richiesto per riscaldare l'acqua da 9 ° C a 10 ºC, ad esempio.
Ecco perché la definizione contempla intervalli ben definiti: 14.5 a 15.5 ° C e 63 a 64 ° F rispettivamente per calorie e BTU.
Ciò che dipende dalla quantità di calore assorbita?
La quantità di calore assorbito che raccoglie un materiale dipende da diversi fattori:
- Massa. Più alta è la massa, più calore è in grado di assorbire.
- Caratteristiche di sostanza. Ci sono sostanze che a seconda della loro struttura molecolare o atomica, sono in grado di assorbire più calore di altre.
- Temperatura. È necessario aggiungere più calore per ottenere una temperatura più alta.
La quantità di calore, indicata come Q, È proporzionale ai fattori descritti. Pertanto, puoi scrivere come:
Q = m.C.ΔT
Dove M È la massa dell'oggetto, C è una costante chiamata calore specifico, una proprietà intrinseca della sostanza e ΔT È la variazione di temperatura ottenuta assorbendo il calore.
ΔT = TF - TO
Questa differenza ha un segno positivo, poiché quando si prevede che si prevede il calore TF > TO. Ciò accade a meno che la sostanza non stia subendo un cambiamento di fase, come l'acqua quando il fluido a vapore passa. Quando l'acqua bolle, la sua temperatura rimane costante a circa 100 º C, indipendentemente dalla velocità con cui bolle.
Come calcolarlo?
Contattando due oggetti a una temperatura diversa, dopo un po 'raggiungono entrambi l'equilibrio termico. Quindi, le temperature sono equalizzate e il trasferimento di calore cessa. Lo stesso accade se più di due oggetti sono in contatto. Dopo un certo tempo, tutti saranno alla stessa temperatura.
Può servirti: magnetizzazione: momento magnetico orbitale e spin, esempiSupponendo che gli oggetti in contatto formino un sistema chiuso, da cui il calore non può sfuggire, viene applicato il principio di risparmio energetico, quindi si può affermare che:
Q assorbito = - Q Scarsamente
Ciò rappresenta un equilibrio energetico, simile a quello degli ingressi e delle spese di una persona. Ecco perché il calore ceduto ha un segno negativo, poiché per l'oggetto che produce, la temperatura finale è inferiore alla iniziale. Perciò:
ΔT = TF - TO < 0
L'equazione q assorbito = - Q Scarsamente Viene usato ogni volta che due oggetti sono in contatto.
Il bilancio energetico
Per eseguire l'equilibrio energetico è necessario distinguere gli oggetti che assorbono il calore da quelli che producono, quindi:
Σ qK= 0
Cioè, la somma dei guadagni di energia e delle perdite in un sistema chiuso deve essere uguale a 0.
Il calore specifico di una sostanza
Per calcolare la quantità di calore assorbito, è necessario conoscere il calore specifico di ciascuna sostanza partecipante. Questa è la quantità di calore necessaria per aumentare la temperatura di 1 g di materiale di 1 º C. Le sue unità nel sistema internazionale sono: joule/kg . K.
Esistono tabelle con il calore specifico di numerose sostanze, generalmente calcolate utilizzando un calorimetro o strumenti simili.
Un esempio di come calcolare il calore specifico di un materiale
Sono necessarie 250 calorie per aumentare la temperatura di un anello metallico da 20 a 30 ºC. Se l'anello ha una massa di 90 g. Qual è il calore di calore specifico nelle unità SI?
Soluzione
Le unità vengono convertite per la prima volta:
Q = 250 calorie = 1046.5 J
M = 90 g = 90 x 10-3 kg
Può servirti: shock elastici: in una dimensione, casi speciali, esercizi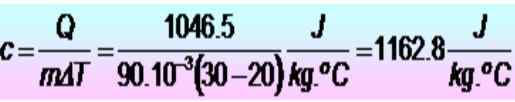
Esercizio risolto
Una tazza di alluminio contiene 225 g di acqua e un agitatore di rame da 40 g, tutto a 27 ° C. Un campione di 400 g di argento a una temperatura iniziale di 87 ° C è posizionato in acqua.
L'agitatore viene utilizzato per mescolare la miscela fino a raggiungere la sua temperatura di equilibrio finale di 32 ° C. Calcola la massa della tazza di alluminio, considerando che non ci sono perdite di calore verso l'ambiente.
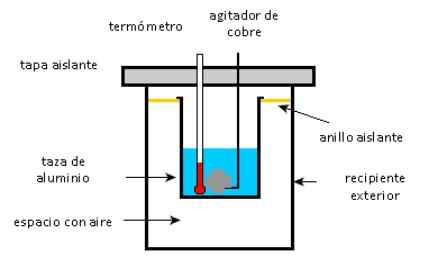 Schema di un calorimetro. Fonte: Solidswiki.
Schema di un calorimetro. Fonte: Solidswiki. Approccio
Come indicato sopra, è importante distinguere gli oggetti che producono calore da quelli che assorbono:
- Tazza di alluminio, rame e agitatore dell'acqua assorbire il calore.
- Il campione d'argento produce calore.
Dati
Vengono forniti i calcoli specifici di ciascuna sostanza:
- Argento: c = 234 J/kg. ºC
- Rame: c = 387 J/kg. ºC
- Alluminio C = 900 J/kg. ºC
- Acqua c = 4186 J/kg. ºC
Il calore assorbito o assegnato da ciascuna sostanza viene calcolato per equazione:
Q = m.C.λT
Soluzione
Argento
Q Scarsamente = 400 x 10 -3 . 234 x (32 - 87) J = -5148 J
Agitatore di rame
Q assorbito = 40 x 10 -3 . 387 x (32 - 27) J = 77.4 J
Acqua
Q assorbito = 225 x 10 -3 . 4186 x (32 - 27) J = 4709.25 J
Coppa di alluminio
Q assorbito = m alluminio . 900 x (32 - 27) J = 4500 .M alluminio
Facendo uso di:
Σ qK= 0
77.4 + 4709.25 + 4500 .M alluminio = - (-5148)
Finalmente la massa in alluminio viene cancellata:
M alluminio = 0.0803 kg = 80.3 g
Riferimenti
- Giancoli, d. 2006. Fisica: principi con applicazioni. 6th. Ed. Prentice Hall. 400 - 410.
- Kirkpatrick, l. 2007. Fisica: uno sguardo al mondo. 6ta Edizione abbreviata. Apprendimento del Cengage. 156 - 164.
- Rex, a. 2011. Fondamenti di fisica. Pearson. 309 - 332.
- Sears, Zemansky. 2016. Fisica universitaria con fisica moderna. 14th. Volume 1. 556 - 553.
- Serway, r., Vulle, c. 2011. Fondamenti di fisica. 9n / a Apprendimento del Cengage. 362 - 374
- « Struttura adenina, biosintesi, funzioni
- Caratteristiche, tipi, funzioni ed esempi di macromolecole »

