Componente della catena del trasporto elettronico, sequenza, inibitori
- 1117
- 222
- Zelida Gatti
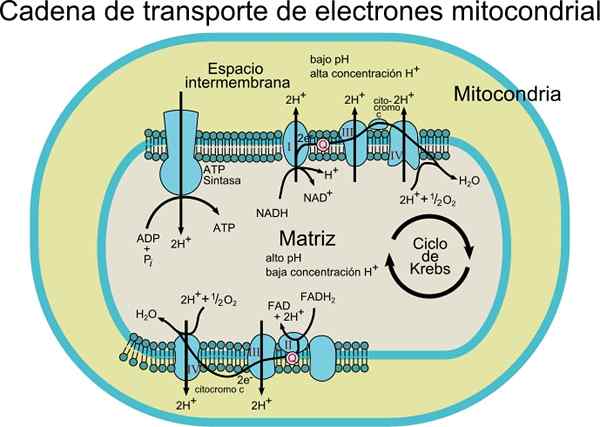
IL Catena del trasportatore elettronico È costituito da una serie di molecole di proteina e coenzima all'interno di una membrana. Come suggerisce il nome, è responsabile del trasporto di elettroni dai coenzimi NADH o FADH2 al ricevitore finale che è O2 (ossigeno molecolare).
In questo processo di trasporto, l'energia rilasciata trasferendo gli elettroni dai coenzimi all'ossigeno molecolare da parte dei centri redox uniti alla proteina, è associata alla produzione di energia (ATP). Questa energia è ottenuta grazie al gradiente protonico generato nella membrana interna mitocondriale.
 Fonte: Utente: Rozzychan [CC BY-SA 2.5 (https: // creativeCommons.Org/licenze/by-sa/2.5)]
Fonte: Utente: Rozzychan [CC BY-SA 2.5 (https: // creativeCommons.Org/licenze/by-sa/2.5)] Questo sistema di trasporto è costituito da vari componenti che possono essere trovati in almeno due stati di ossidazione. Ognuno di essi è effettivamente ridotto e reossidico durante il movimento degli elettroni da NADH o FADH2 a O2.
I coenzimi NAD+ e FAD sono ridotti nelle rotte di ossidazione degli acidi grassi e nel ciclo dell'acido citrico a seguito dell'ossidazione di vari substrati. Successivamente questi coenzimi sono ossidati nella catena di trasporto elettronico.
In modo che il sistema di trasporto elettronico consiste in una sequenza di reazioni di riduzione dell'ossido che sono collegate tra loro.
[TOC]
Componenti a catena
A seconda del tipo di organismo, si può osservare da 3 a 6 componenti che costituiscono la catena del trasportatore di elettroni. Il processo di trasporto degli elettroni e la sintesi di ATP mediante fosforilazione ossidativa sono processi che si verificano in una membrana.
Nel caso delle cellule procariotiche (batteri aerobici), questi processi si verificano associati alla membrana plasmatica. Nelle cellule Eucariota si verifica nella membrana mitocondriale, quindi i componenti di trasporto degli elettroni si trovano nella parte interna della membrana.
https: // giphy.com/gifs/htksbbedquk9z7co5e
Gli elettroni vengono gradualmente trasferiti attraverso quattro complessi che compongono la catena di trasporto elettronico.
Ogni complesso ha diversi componenti proteici associati a gruppi protesici (componenti non aminoacidi di proteine coniugate) redox, che consentono ai loro potenziali di riduzione di aumentare.
Inoltre, questo sistema di trasporto è costituito da varie specie molecolari come la flavoproteina; coenzima che ha anche chiamato ubiquinona (coq o uq); vari citocromi come il citocromo B, C, C1, A e A3; Proteine con Fe-S e gruppi proteici legati a Cu. Queste molecole sono collegate alla membrana, ad eccezione del citocromo c.
Complesso i
https: // giphy.com/gifs/rlf1rl9gdc6356sj6w
Il complesso I chiamato NADH Coenzyme chinona ossidortaduasi, o NADH deidrogenasi, è costituito da circa 45 catene polipeptidiche e contiene una molecola flavina mononucleotidica (FMN) e da otto a nove gruppi FE-S-S. Come suggerisce il nome, questo complesso trasferisce una coppia di elettroni dal coenzima NADH a CoQ.
La funzione del complesso NADH deidrogenasi inizia con l'unione di NADH a detto complesso sul lato della matrice di membrana mitocondriale interna. Gli elettroni vengono quindi trasportati da NADH alla FMN. Successivamente, gli elettroni passano dalla ridotta flavina (FMNH2) alle proteine Fe-S.
L'FMNH2 funziona come una sorta di ponte tra le proteine NADH e Fe-S, poiché quest'ultimo può trasferire solo un singolo elettrone, mentre il coenzima NADH trasferisce due, in modo che le Flavinas effettuano questo trasferimento di un singolo elettrone grazie al suo redox del semi -calato.
Può servirti: monocitopoiesi: fasi, caratteristiche, regolamentazioneInfine, gli elettroni vengono trasferiti dai raggruppamenti Fe-S al Coenzyme Q, che è un trasportatore di elettroni mobili con una coda isopreneide che lo rende idrofobo che consente di attraversare il centro della membrana mitocondriale.
Complesso II

Il complesso ii, meglio noto come succinato deidrogenasi, è una proteina integrale della membrana interna mitocondriale ed è un enzima che interviene nel ciclo dell'acido citrico.
Questo complesso è costituito da due subunità idrofili e due idrofobici con gruppi di emo B che forniscono il sito di legame COQ, oltre a una flavoproteina e una proteina con Fe-S.
Nel ciclo dell'acido citrico (krebs o ciclo di acido tricarbossilico), il succinato viene convertito in fumarato mediante succinato deidrogenasi, riducendo la moda del coenzima a FADH2. Da quest'ultimo coenzima, gli elettroni vengono trasferiti ai centri Fe-S che a loro volta li trasferiscono al CoQ.
Durante le reazioni di questo trasferimento di elettroni, il potenziale redox standard è molto basso, il che impedisce l'energia libera necessaria di essere rilasciata per sintetizzare ATP.
Ciò significa che il complesso II è l'unico complesso nella catena di trasporto degli elettroni incapaci di fornire energia per la sintesi di ATP. Tuttavia, questo complesso è la chiave nel processo, poiché trasferisce gli elettroni da FADH2 al resto della catena.
Complesso III
https: // giphy.com/gifs/cjg0raiuizjds2hkyu
Il complesso III, complesso citocromo BC1 o COQ Cytocrome C reduttasi, trasferisce gli elettroni dal coenzima ridotto al citocromo c. Questo trasferimento avviene attraverso una singola strada redox, che è nota come ciclo Q.
Questo complesso è costituito da una proteina con Fe-S e tre diversi citocromi, in cui l'atomo di ferro situato nel gruppo Hemo varia ciclicamente tra gli stati ridotti (Fe2+) e ossidato (Fe3+).
I citocromi sono emoproteine del trasporto elettronico, che hanno attività redox. Sono presenti in tutti gli organismi, ad eccezione di alcuni anaerobi obbligatori.
Queste proteine hanno gruppi di emo che si alternano tra due stati di ossidazione (Fe2+ e Fe3+). Il citocromo C è un trasportatore di elettroni mobili debolmente associato alla membrana interna dei mitocondri.
I citocromi trovati in questo complesso sono i citocromi B, C e A, i 3 sono proteine redox attive con gruppi abbiamo caratteristiche diverse, che alternano i loro stati di ossidazione tra Fe2+ e Fe3+.
Il citocromo c è una proteina di membrana periferica che funziona come una "navetta" di elettrone con citocromo C1 e con il complesso IV.
Complesso IV
Il citocromo C e gli O2 sono i recettori finali degli elettroni derivati dall'ossidazione del materiale organico, quindi il complesso IV o citocromo C ossidasi è l'enzima terminale nel processo di trasporto elettronico. Questo accetta elettroni dal citocromo c e li trasferisce alla riduzione di O2.
La funzione complessa è quella di catalizzare le ossidazioni di un elettrone delle quattro molecole consecutive di citocromo r ridotto, ovvero riduce contemporaneamente quattro elettroni di una molecola O2, producendo infine due molecole H2O.
Può servirti: tessuto di rivestimento epitelialeSequenza di trasporto elettronico
Gli elettroni vengono trasferiti dai complessi I e II al complesso III grazie al coenzima Q, e da lì passano al complesso IV attraverso il citocromo c. Quando gli elettroni passano attraverso questi quattro complessi, il potenziale di riduzione aumenta, rilasciando energia, che viene quindi utilizzata per la sintesi di ATP.
In totale, il trasferimento di un paio di elettroni provoca la traslocazione di 10 protoni attraverso la membrana; quattro in complessi I e IV e due del complesso III.
Nadh Descidrogenasa
Questo enzima catalizza l'ossidazione del coenzima NADH da parte del coenzima che. Gli elettroni si spostano dal NADH alla FMN che è attaccata alla coda idrofila del complesso i. I raggruppamenti Fe-S trasferiscono agli elettroni alla volta. Questi gruppi Fe-S si riducono al CoQ, che è incorporato nella membrana, a Ubiquinolo (ridotto CoQ).
Durante il trasferimento di elettroni al CoQ, quattro protoni vengono a loro volta trasferiti attraverso la membrana interna, nello spazio intermembrano. Il meccanismo con cui sono traslocati questi protoni coinvolge proteine situate nella coda idrofobica del complesso i.
Il processo di trasferimento di elettroni in questo passaggio rilascia energia libera, in particolare -16,6 kcal/mol/mol.
Coq-citocromo C reduttasi e il ciclo Q
Il coenzima che è ossidato dal citocromo c, in una reazione catalizzata da questo coenzima. L'ossidazione dell'ubiquinolo (ridotta CoQ) si verifica in un determinato sito del complesso (QO o sito di ossidazione) nella membrana mitocondriale, trasferendo due elettroni, uno nella proteina con i gruppi Fe-S e un altro ai gruppi di Hemo.
Nel ciclo Q, l'ossidazione di COQ produce semi -iquinone, che è dove gli elettroni vengono trasferiti nei gruppi di Hemo B1 e BH. Mentre si verifica questo trasferimento di elettroni, un secondo COQ si ossida nel sito QO, ripetendo il ciclo.
Questo ciclo provoca il trasferimento di due elettroni e, a sua volta, la traslocazione di quattro protoni nello spazio intermembrano, con il rilascio di -10,64 kcal/mol di energia libera.
Citocroma C ossidasi
Questo enzima (complesso IV) catalizza l'ossidazione del citocromo C (ridotto) da O2, che è l'accettore di elettroni finali. Questo trasferimento produce una molecola H2O per ciascuna coppia di elettroni trasferiti oltre alla traslocazione di protoni attraverso la membrana.
Gli elettroni passano da uno a uno, dal citocromo c ridotto a una coppia di ioni CUA, quindi passano a un gruppo di Hemo A e infine raggiungono il centro binucleare del complesso che contiene cuccioli e ioni Hemo A3, dove il trasferimento di quattro Gli elettroni si verificano all'ossigeno.
Nel complesso IV gli elementi trasferiscono gli elettroni di uno per uno, in modo che l'O2 sia ridotto gradualmente, in modo che non si verifichi il rilascio di alcuni composti tossici come superossido, perossido di idrogeno o radicali idrossilici.
L'energia rilasciata in questa fase corrisponde a -32 kcal/mol. Il gradiente elettrochimico generato durante il processo di trasferimento e le variazioni di energia (ΔE) causate da un paio di elettroni quando si passa attraverso i quattro complessi, corrisponde, in ogni fase, all'energia libera necessaria per la produzione di una molecola ATP.
Può servirti: teoria del pieghevole della membranaGrande deidrogenasi
Come accennato, questo complesso ha l'unica ma importante funzione di introdurre gli elettroni FADH2 dal ciclo dell'acido citrico alla catena di trasporto degli elettroni.
Questo enzima catalizza l'ossidazione del coenzima FADH2 da parte del coenzima Q (ossidato). Nel ciclo dell'acido citrico quando il succinato al fumarato, due elettroni e due protoni vengono trasferiti alla FAD. Successivamente il FADH2 trasferisce questi elettroni fino a coq attraverso i centri Fe-S del complesso.
Infine, dal CoQ gli elettroni vengono trasferiti al complesso III, seguendo i passaggi sopra descritti.
I complessi della catena sono indipendenti
I quattro complessi che compongono la catena di trasporto elettronico sono indipendenti, cioè sono indipendentemente e operano nella membrana interna mitoccondiale e il movimento di ciascuno di essi nella membrana non dipende o è collegato agli altri complessi.
I complessi I e II si muovono sulla membrana trasferendo i loro elettroni in CoQ che si diffonde anche nella membrana e li trasferisce al complesso III, da cui gli elettroni passano al citocromo C che è anche mobile nella membrana e deposita elettroni nel complesso IV.
Inibitori della catena di trasporto elettronico
Sulla catena di trasporto elettronico alcuni inibitori specifici agiscono nel loro processo. Rothenone è un insetticida comunemente usato che si unisce stechiometricamente al complesso I, evitando la riduzione di CoQ.
Alcuni farmaci di tipo barbiturici come piericidina e amytal, inibiscono il complesso I, interferendo con il trasferimento di elettroni dai gruppi Fe-S al CoQ.
Nel complesso II alcuni composti come teiltrifluoroacetone e malonato agiscono come inibitori competitivi con succinato, evitando la loro ossidazione e, a sua volta, il trasferimento di elettroni alla moda.
Alcuni antibiotici come il mixotiazolo e la stigmatellina, si legano al sito Q del CoQ, inibendo il trasferimento di elettroni dal coenzima Q ai centri Fe-S delle proteine.
Cianuro, azida (N3-), acido solforico e monossido di carbonio inibiscono il complesso IV. Questi composti si legano ai gruppi emo, evitando il trasferimento di elettroni al centro binucleare complesso o di ossigeno (O2) (O2).
Quando viene inibita la catena del trasportatore di elettroni, la produzione di energia viene interrotta a causa della fosforilazione ossidativa, causando gravi danni e persino la morte dell'organismo.
Riferimenti
- Alberts, b., Bray, d., Hopkin, k., Johnson, a., Lewis, J., Raff, m., Roberts, k. & Walter, P. (2004). Biologia cellulare essenziale. New York: Garland Science. 2a edizione.
- Cooper, g. M., Hausman, r. E. & Wright, n. (2010). La cellula. (pp. 397-402). Ed. Marbán.
- Devlin, t. M. (1992). Libro di testo di biochimica: con correlazioni cliniche. John Wiley & Sons, Inc.
- Garrett, r. H., & Grisham, C. M. (2008). Biochimica. Ed. Thomson Brooks/Cole.
- Rawn, j. D. (1989). Biochimica (n. 577.1 crudo). Ed. Inter-American-McGraw-Hill
- Voet, d., & Voet, J. G. (2006). Biochimica. Ed. Pan -American Medical.
- « Caratteristiche di anguila elettrica, habitat, riproduzione
- Caratteristiche dei biozoi, morfologia, riproduzione, nutrizione »

