Struttura del bromuro di litio, proprietà, usi, rischi
- 2788
- 841
- Dott. Rodolfo Gatti
Lui Bromuro di litio È un sale neutro di un metallo alcalino la cui formula chimica è Libr. La formula esprime che il suo solido cristallino è composto da li ioni+ e br- In un rapporto 1: 1. I tuoi cristalli sono bianchi o leggeri. È molto solubile nell'acqua e anche è un sale piuttosto igroscopico.
Quest'ultima proprietà consente il suo uso come essiccante nei sistemi di condizionamento e raffreddamento. Allo stesso modo, il bromuro di litio è stato usato dall'inizio del 20 ° secolo nel trattamento di alcuni disturbi della salute mentale, abbandonando il suo uso a causa dell'uso inappropriato di sale.
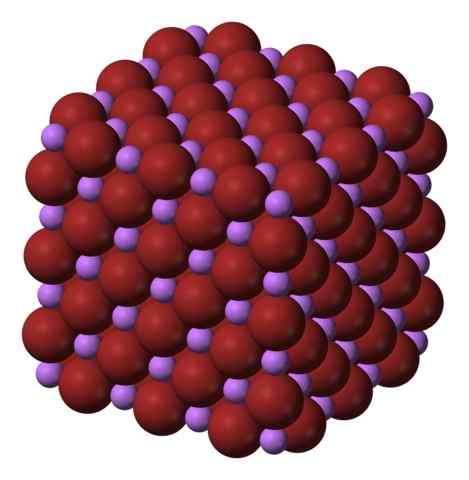
 Struttura cristallina cubica di Libr. Fonte: Benjah-BMM27 via Wikipedia.
Struttura cristallina cubica di Libr. Fonte: Benjah-BMM27 via Wikipedia. Il Libr è prodotto dal trattamento del carbonato di litio, Li2Co3, con acido bromiterico. Dopo il riscaldamento del mezzo, precipita nella soluzione acquosa come idrato.
Questo sale irrita la pelle e gli occhi per contatto, producendo l'irritazione dei condotti respiratori per inalazione. L'assunzione di sali di litio può causare nausea, vomito, diarrea e vertigini.
[TOC]
Struttura del bromuro di litio
La formula LIBR chiarisce che la proporzione Li/Br è uguale a 1; Per ogni cation Li+ Ci deve essere un anione BR- di controparte. Pertanto, questa proporzione deve essere mantenuta costante in ogni angolo del cristallo Libr.
Gli ioni li+ e br- Si attirano a vicenda, riducendo le repulsioni tra carichi uguali, al fine di causare un tipo di gemma di cristallo cubico; Questo è isomorfo per NaCl (immagine superiore). Si noti che l'intero set ha una geometria cubica.
In questo cristallo, il Li+ Sono più piccoli e hanno un chiaro colore viola; mentre il BR- Sono più voluminosi e un intenso colore marrone. Si osserva che ogni ione ha sei vicini, il che è lo stesso di dire che presentano un coordinamento ottaedrico: BIRB6 o li6BR; Tuttavia, se viene considerata la cellula unitaria, la proporzione Li/Br rimane 1.
Può servirti: struttura cristallinaQuesta è la struttura cristallina adottata preferibilmente da Libr. Tuttavia, può anche formare altri tipi di cristalli: Wurzita, se cristallizza a basse temperature (-50 ° C) su un substrato; O cubici centrati sul corpo o tipo CSCL, se il sale di vetro cubo è sottoposto ad alta pressione.
Idrato e vetro
Quanto sopra è applicabile per il Libr anidro. Questo sale è igroscopico e quindi può assorbire l'umidità dell'ambiente, intervallando le molecole d'acqua nei loro cristalli. Pertanto, si presentano idrati di ebrir · nh2O (n = 1, 2, 3 ..., 10). Per ogni idrato, la struttura cristallina è diversa.
Ad esempio, gli studi cristallografici hanno determinato che la libreria2O adottare una struttura di tipo perovskita.
Quando questi idrati sono in soluzione acquosa, possono traboccare e vetrificarsi; Cioè, adottano una struttura cristallina, ma molecolare disordinata. In tali condizioni, i ponti idrogeno d'acqua diventano piuttosto importanti.
Proprietà
Peso molecolare
88.845 g/mol.
Aspetto
Beige solido o leggero cristallino bianco.
Odore
Gabinetto.
Punto di fusione
552 ºC (1.026 ºF, 825 K).
Punto di ebollizione
1.256 ºC (2.309 ºF, 1.538 K).
Solubilità dell'acqua
166,7 g/100 ml a 20 ° C. Nota la tua elevata solubilità.
Solubilità nei solventi organici
Solubile in metanolo, etanolo, etere e acetone. Leggermente solubile in piridina, composto aromatico e meno polare rispetto ai precedenti.
Indice di rifrazione (ηd)
1.784.
Capacità calorica
51,88 J/mol · K.
Entropia molare standard (sθ 298)
66,9 J/mol · K.
punto di accensione
1.265 ºC. È considerato non infiammabile.
Stabilità
Stabile. La forma Anhydra, tuttavia, è estremamente igroscopica.
Decomposizione
Quando si decompone dal riscaldamento, provoca ossido di litio.
Può servirti: acido clorogenicoph
Tra pH 6 e 7 in soluzione acquosa (100 g/L, 20 ºC).
Reattività
Il bromuro di litio non è reattivo in normali condizioni ambientali. Tuttavia, puoi sperimentare reazioni intense con acidi forti quando la temperatura aumenta.
Quando si dissolve in acqua, c'è un aumento della temperatura, causato da un'entalpia negativa di idratazione.
Produzione
LIBR si verifica reagendo con idrossido di litio o carbonato di litio con acido bromoriterico in una reazione di neutralizzazione:
Li2Co3 + HBr => Libl +Co2 + H2O
Il bromuro di litio è ottenuto come idrato. Per ottenere forma anidra, è necessario riscaldare il sale idratato sotto vuoto.
Nomenclatura
Il nome "Lithium Bromide" deriva dall'essere un alogenuro metallico, chiamato secondo la nomenclatura delle azioni. Altri nomi, altrettanto validi ma meno usati, sono il monobromure del litio, secondo la nomenclatura sistematica; e il bromuro litico (la valenza unica di +1 per il litio), secondo la nomenclatura tradizionale.
Applicazioni
Essiccante
Il Libr è un sale igroscopico, che forma una salamoia concentrata in grado di assorbire l'umidità dell'aria in una vasta gamma di temperature. Questa salamoia viene utilizzata come essiccante nei sistemi di condizionamento e raffreddamento.
Fibre
Viene utilizzato per aumentare il volume di lana, capelli e altre fibre organiche.
Forniti farmaceutici
L'IBR forma addutti con alcuni composti farmaceutici, modulando la sua azione. Un addotto è la combinazione coordinando due o più molecole, senza un'alterazione strutturale di nessuna delle molecole unite.
Sedativo
Il bromuro di litio è stato usato all'inizio come sedativo in alcuni disturbi mentali, smettere di usare nel 1940. Attualmente viene utilizzato il carbonato di litio; Ma in ogni caso, il litio è l'elemento che esercita l'azione terapeutica in entrambi i composti.
Può servirti: ossido di impianto (PBO): formula, proprietà, rischi e usiIl litio è usato nel trattamento del disturbo bipolare, essendo stato utile nel controllo degli episodi maniacali del disturbo. Si pensa che il litio inibisca l'attività dei neurotrasmettitori eccitatori, come la dopamina e l'acido glutammico.
D'altra parte, l'attività del sistema inibitorio mediata dal neurotrasmettitore l'acido gamma-amino-butirrico (GABA) aumenta (GABA). Queste azioni potrebbero far parte della base dell'azione terapeutica del litio.
Rischi
Contattare la tossicità
Irritazione e sensibilizzazione cutanea, allergie. Gravi lesioni oculari o irritazione agli occhi, sul tratto respiratorio, le narici e la gola.
Ingestione
I sintomi principali dovuti all'assunzione di bromuro di litio sono: disturbi gastrointestinali, vomito e nausea. Altri effetti avversi sull'ingestione di sale includono agitazione, spasmi e perdita di coscienza.
La condizione nota come "bromismo" può verificarsi con dose di litio -bromuro maggiore di 225 mg/giorno.
Nel bromismo possono verificarsi alcuni dei seguenti sintomi e segni: esacerbazione dell'acne e perdita di appetito, tremori, problemi vocali, apatia, debolezza e agitazione maniacale.
Riferimenti
- Formulazione chimica. (2019). Bromuro di litio. Recuperato da: formulazione Quimica.com
- David c. Johnson. (10 luglio 2008). Nuovo ordine per bromuro di litio. Natura. doi.org/10.1038/454174a
- Aayushi jain & r.C. Dixit. (S.F.). Transizione di fase strutturale nel bromuro di litio: effetto della pressione e della temperatura. [PDF]. Recuperato da: NCPCM.In
- Takamuku et al. (1997). Studi di diffrazione di raggi X su soluzioni di ioduro di bromuro di litio e litio super raffreddato. Dipartimento di Chimica, Facoltà di Scienze, Università di Fukuoka, Nanakuma, Jonan-Ku, Fukuoka 814-80, Giappone.
- Centro nazionale per le informazioni sulla biotecnologia. (2019). Bromuro di litio. Database PubChem, CID = 82050. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov
- Wikipedia. (2019). Bromuro di litio. Recuperato da: in.Wikipedia.org
- Royal Society of Chemistry. (2019). Bromuro di litio. Chemspider. Recuperato da: Chemspider.com
- « Alchil Halogenuros Proprietà, ottenendo, esempi
- Messico negli atti e cambiamenti socioeconomici del 18 ° secolo »

