Storia del borace, struttura, proprietà, usi, sintesi, rischi

- 1425
- 109
- Baldassarre Ross
Lui Borace o borato di sodio È una denominazione per un gruppo di composti chimici con una formula di base di NA2B4O7. È un sale igroscopico in grado di formare numerosi idrati, oltre ad arricchirsi strutturalmente dalla presenza di alcune impurità metalliche.
I composti principali che sono chiamati borace sono i seguenti: anidro sodio tetraborato, na2B4O7; Tetraborato di sodio pentaidrato (NA2B4O7).5h2O; e tetraborato di sodio, na2B4O7.10h2O, o il suo equivalente, il tetraborato di sodio ottaidrato, Na2B4O5(OH)4.8h2O.
 Frammento di borace. Fonte: Leon Hupperichs [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]
Frammento di borace. Fonte: Leon Hupperichs [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)] Come si può vedere, tutti i solidi precedenti differiscono solo nel loro grado di idratazione; Alcuni hanno più molecole d'acqua nei loro cristalli rispetto ad altri. Il borace fisicamente è simile a pezzi o cristalli di gesso robusti (immagine superiore).
Naturalmente, il borace si trova nei sedimenti dei laghi stagionali, essiccato per evaporazione. Il borace si verifica in Turchia, Searles Lakes (California), in Atacama, Cile, Bolivia, Tibet e Romania Desert. Sinteticamente, i cristalli di borace possono essere ottenuti attraverso un processo di nucleazione lento; Cioè, in cui è favorita la crescita dei cristalli.
Il tetraborato di sodio, anidro e decadici è poco solubile in acqua fredda; Ma la sua solubilità aumenta con un aumento della temperatura. Poi un2B4O7.10h2Oppure è molto solubile in glicole etilenico, moderatamente solubile in etanolo e poco solubile in acetone; Questi sono meno solventi polari dell'acqua.
Il borace ha numerose applicazioni, come nell'elaborazione di detergenti e saponi; come ritardo del fuoco del materiale cellulosico; nella produzione in fibra di vetro; Nella pulizia di superfici dure come metalli, vetro e ceramica; e nell'inibizione della corrosione, tra gli altri usi.
Il borace è irritante per gli occhi, la pelle e il tratto respiratorio. Per ingestione può produrre, tra gli altri sintomi, vomito, diarrea, rilassamento, decadimento e convulsioni. Attualmente si sospetta che gli effetti dannosi sulla riproduzione umana possano avere.
[TOC]
Storia
La storia del borace è confusa. È sottolineato che è stato scoperto nel letto di un lago Tibet, essiccato per evaporazione. Fu trasferito nel settimo secolo di Tibet in Arabia Saudita, seguendo la via della seta così chiamata.
Il termine "borace" era popolare a seguito delle numerose applicazioni che sono state trovate e commercializzate con il nome di 20 Mule Team Borax Tradermax, che si riferiva al modo in cui il borace veniva trasportato attraverso i deserti del Nevada e della California.
Un'altra versione della loro scoperta indica che gli egiziani avevano conosciuto per la loro esistenza da molto tempo, usandola nelle saldature dei metalli dal calore. Inoltre, lo hanno usato in medicina e nel processo di mummificazione. Il borace fu trasferito in Europa nel XIII secolo da Marco Polo.
A metà del nord secolo, nel deserto di Magove sono stati scoperti grandi depositi di borace.
Struttura del borace
 Struttura ionica di borace. Fonte: Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)]
Struttura ionica di borace. Fonte: Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] L'immagine superiore mostra gli ioni che compongono il borace, in particolare corrispondenti a un solido con una formula compositiva di NA2[B4O5(OH)4] · 8h2O (o na2B4O7· 10h2O).
Innanzitutto, si può notare la struttura in gabbia dell'anione [b4O5(OH)4"2- (Anche se dovrei avere due gruppi-), in cui si può vedere un anello ottagonale (quattro atomi di B e quattro di O)), con un ponte B-O-B che lo dividi in due metà.
Può servirti: soluzioni alcaline: definizione, proprietà e usiQuesta gabbia non rimane statica, ma vibra e adotta diverse conformazioni nello spazio; Tuttavia, in misura minore nelle vicinanze del ponte. Si può anche notare che è molto "ossigenato"; Cioè, ha molti atomi di ossigeno, in grado di interagire con molecole d'acqua usando ponti idrogeno.
Non sorprende quindi che i cristalli di borace possano idratare e generare numerosi idrati. Quindi, per il sol solido2[B4O5(OH)4] · 8h2Oppure ci sono otto molecole H2O interagire con la gabbia borarata e allo stesso tempo, con i centri metallici di NA+.
Sul lato cationico, hai il complesso acquoso [NA (H2O)4"+N, Laddove il valore di N dipenderà dalla proporzione anionica/catione. Nel solido superiore, n = 2, quindi hai: [na2(H2O)8"2+, il cui carico 2+ neutralizza il carico 2- dell'anione borarato.
Cristalli
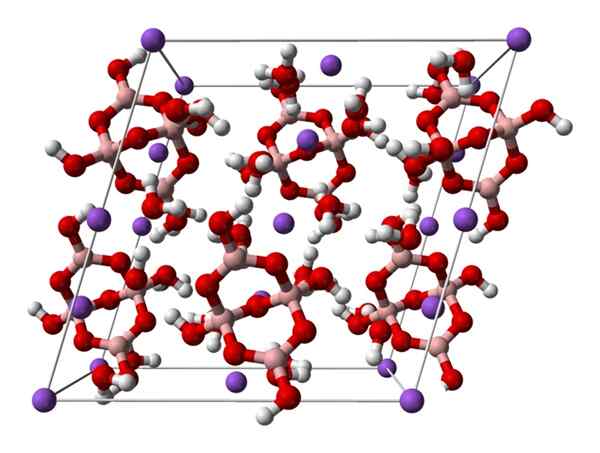 Cellula monoclinica di borace. Fonte: Ben Mills [pubblico
Cellula monoclinica di borace. Fonte: Ben Mills [pubblicoDominio].
Su2[B4O5(OH)4] · 8h2O o na2B4O7· 10h2O. Qui attrazioni elettrostatiche e ponti idrogeno regolano o dominano i modelli strutturali originati in ogni bicchiere del vetro.
Altri idrati e sale anidro perdono una o tutte le loro molecole d'acqua, alterando la composizione e la struttura del cristallo di borace. In tutti loro, l'anione e il catione rimangono gli stessi (a meno che non vi siano impurità o reazioni laterali), quindi non può essere generata confusione.
Confusioni con l'anione boraato
N / a2[B4O5(OH)4] · 8h2O e na2B4O7· 10h2O sono gli stessi. Perché?
Innanzitutto, se i loro atomi vengono contati, vedranno che coincidono in numero; E in secondo luogo, in anione b4O72- Viene considerata l'assenza dei due gruppi OH legati alle teste di boro dei ponti B-O-B; due oh quello, insieme ai due h+ da b4O72-, Aggiungi fino a 2 ore2Oppure, dando un totale di 10 ore2O (8 + 2).
Proprietà
Nomi
- Borace.
- Sodio borarato.
- Tetraborato di sodio.
- Tetraborato datorabile.
Massa molecolare
Anhydro: 201,22 g/mol.
Decoidrato: 381,38 g/mol.
Aspetto fisico
Un solido bianco cristallino.
Densità
Anidro: 2,4 g/cm3
Decahixture: 1.739 g/cm3
Punto di fusione
Anhidro: 743 ºC (1.369 ºF, 1.016 K).
Decoidrato: 75 ºC.
Punto di ebollizione
Anhidro: 1.575 ºC (2.867 ºF, 1.848 K).
Solubilità dell'acqua
31,78 g/L (sia per anidro che decayroper).
Solubilità nei solventi organici
È molto solubile in glicole etilenico, moderatamente solubile in glicole dietilenico e metanolo e leggermente solubile in acetone.
Indice di rifrazione (ηd)
Anhidro: η1 = 1.447; η2 = 1.469.
Decayedrado: η2 = 1.472.
Stabilità
È stabile in condizioni di archiviazione adeguate. Sebbene abbia una bassa pressione del vapore, aumenta con la temperatura, causando cristallizzazione e condensa, quindi dovrebbero essere evitate fluttuazioni eccessive di temperatura e umidità.
Emissione di luce
Il sodio tetraborato se sottoposto all'azione del fuoco emette una luce verde.
Reazioni
- Quando si dissolve nell'acqua, le soluzioni alcaline hanno origine con un pH intorno a 9,2.
- Il borace reagisce a formare altri borati, come il perborato (PBS).
- Produce anche acido borico quando reagisce con acido cloridrico:
N / a2B4O7· 10h2O + HCl => 4 H3Bo3 + 2 na+ + 2 Cl- + 5 h2O
- Il tetraborato di sodio si comporta come una sostanza anfoheta, poiché in soluzione acquosa è idrolizzato ed è in grado di neutralizzare l'acido. Allo stesso modo, è in grado di neutralizzare gli alcali ad alta concentrazione, evitando un'emissione eccessiva del pH medio.
Può servirti: alcol primario: struttura, proprietà, nomenclatura, esempiApplicazioni
Il borace ha numerose applicazioni, sia nell'essere umano che nell'insieme di attività che svolge.
Azione antiossidante
Il borace ha la capacità di dissolvere gli ossidi. Per questo motivo viene utilizzato nel recupero di metalli come ottone, rame, piombo e zinco.
Viene anche usato per prevenire l'ossidazione delle barre metalliche nelle basi. Il borace copre la sua superficie, esclusa l'aria e quindi evitando l'ossidazione. Inoltre, impedisce la corrosione di materiale ferroso nella produzione automobilistica.
La solubilità al borace nel glicole etilenico è stata utile nelle formulazioni antigelo. Il borace neutralizza i rifiuti acidi prodotti durante la decomposizione del glicole etilenico, riducendo al minimo l'ossidazione che la superficie dei metalli può soffrire.
Elaborazione di adesivi
- Il borace fa parte di una formulazione dell'amido adesivo per carta ondulata e cartone.
- È un agente peptivo nella produzione di adesivi basati sulla caseina e la destrina.
- Atti che rafforzano i materiali adesivi attraversando i gruppi di idrossili coniugati.
Ignifugo
È usato come ritardante di incendio nei materiali cellulosici e altri polimeri contenenti gruppi di idrossilli. Esercita la sua azione attraverso diversi meccanismi, tra cui la formazione di uno strato vitreo che limita l'accesso ai carburanti.
Elaborazione in vetro borosilizzato (Pyrex)
Il borace è una fonte di boro utilizzato nell'elaborazione del vetro borosilato; Caratterizzato da un punto di fusione elevato, a basso coefficiente di espansione e elevata resistenza agli shock termici.
Ciò ti consente di essere soggetto a temperature elevate senza sperimentare fratture, ricevendo la denominazione del vetro refrattario.
Il vetro borosilato viene utilizzato nell'elaborazione dei materiali da utilizzare a casa per cuocere alimenti. Viene anche utilizzato in laboratorio in becher, fissola, misura cilindri, pipette, ecc.
Emulsionatore
Il borace, insieme ad altri composti, viene utilizzato per emulsionare i saponi e altri paraffine. È anche usato come base per l'elaborazione di lozioni, creme e unguenti.
Materiale per la pulizia
- Viene aggiunto nelle formulazioni per pulire le superfici ferme come metalli, vetro e ceramica.
- Viene utilizzato in detergenti a mano, materiale di lucidatura e saponi detergenti di utilizzo nelle lavanderie e nella casa. Inoltre, facilita la rimozione di depositi oleosi dai pavimenti delle fabbriche.
Usi medici
- È usato nel trattamento delle infezioni dei funghi dei piedi.
- Fa parte della formula nutritiva che fornisce boro. Si pensa che questo elemento intervenga nel metabolismo del calcio, del fosforo e del magnesio, essendo necessario per la struttura ossea.
- Interviene nella determinazione dell'emoglobina glicosilata (HBA1C), la prova che serve a conoscere lo sviluppo del diabete a lungo termine in un paziente, poiché il tempo di mezza vita di un eritrocita è di 120 giorni.
Queste informazioni sono più utili per il medico che per le determinazioni isolate della glicemia del paziente.
Shock PH Shock
È usato in diversi ammortizzatori di pH utilizzati in biochimica; Tra questi, il tris (idrossimetil) aminometano-boray, usato nell'elettroforesi in poliacrilammide del DNA e degli acidi nucleici dell'RNA.
Diminuzione della durezza dell'acqua
Il borace è in grado di combinarsi con ioni di calcio e magnesio presenti nell'acqua, diminuendo la sua concentrazione. In questo modo la durezza dell'acqua è ridotta.
Può servirti: idrossido di potassio: struttura, proprietà, usiFertilizzante e fertilizzante
Il borace è usato come fonte di boro. Il calcio e il boro sono coinvolti nella formazione della parete cellulare delle piante. Inoltre, è stato sottolineato che il boro favorisce l'impollinazione, quindi interviene nella fecondazione e nella proliferazione delle piante.
Conservazione in legno
Il borace combatte il legno, uno scarabeo che consuma e distrugge il legno. Viene anche usato nella conservazione e nella manutenzione delle navi in legno.
Fondazione e flusso
Viene usato come fondatore in saldatura in acciaio e ferro, causando una diminuzione del punto di fusione e l'eliminazione dell'ossido di ferro; Un inquinante indesiderabile. Con un fine simile, partecipa alla saldatura di oro e argento.
Altri
- È usato come un pesticida morbido; Ad esempio, per il combattimento di falene nella lana.
- Serve spruzzati per il controllo dei parassiti presenti negli armadi, nei depositi interni, nelle lacune delle pareti e in generale, dove non è desiderato l'uso di più pesticidi inquinanti.
- È usato nei reattori nucleari per controllare le reazioni che potrebbero produrre, in casi estremi, una reazione a catena.
- Nei radiatori di auto, il borace viene utilizzato per ottenere i siti in cui ci sono fughe d'acqua.
Sintesi
Il borace è ottenuto da React5O9.8h2O, con carbonato di sodio e idrocarbonato di sodio in mezzo acquoso.
In realtà, la sintesi di tetraborato di sodio o borace è usata poco; La maggior parte del composto prodotto è ottenuto dalla sua estrazione dei minerali che lo contengono.
Il processo può essere riassunto in una soluzione del minerale in acqua, seguito da una filtrazione di argilla e infine a un'evaporazione della soluzione acquosa.
Rischi
Il borace è un prodotto naturale, tuttavia, può produrre una serie di danni alla salute nell'uomo. Ad esempio, a causa del contatto con la polvere di polvere, può verificarsi un'irritazione della pelle che potrebbe causare dermatite.
Allo stesso modo, il borace produce irritazione degli occhi e del tratto respiratorio superiore. Tra i sintomi della sua inalazione, ci sono dolore per la tosse e la gola.
Nel frattempo, l'assunzione di borace presenta i seguenti sintomi: vomito, nausea, diarrea, rilassamento, mal di testa e convulsioni. Inoltre, può verificarsi un'affetto del sistema nervoso centrale e del funzionamento renale.
Dagli studi condotti nei ratti maschi -sesso, alimentati con borace, atrofia testicolare. Mentre gli studi condotti con ratti femminili in gravidanza hanno sottolineato che il borace potrebbe attraversare la placenta, producendo un'alterazione dello sviluppo fetale, manifestato a basso peso alla nascita.
Si ritiene che l'esposizione al borace possa influire sulla funzione riproduttiva maschile nell'uomo, manifestata da una riduzione del conteggio degli spermatozoi.
Una dose fatale da 10 a 25 grammi è stimata per l'assunzione di borace negli adulti.
Riferimenti
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Centro nazionale per le informazioni sulla biotecnologia. (2019). Argon. Database PubChem. CID = 23968. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov
- Karolyn Burns, Seneca Joseph e DR. Ryan Baumbach. (S.F.). Sintesi e proprietà di cristalli di borace e leghe intermetalllic. Recuperato da: Nationalmaglab.org
- Wikipedia. (2019). Borace. Recuperato da: in.Wikipedia.org
- Rio Tinto. (2019). Borace deidrato. 20 Mule Team Borax. Recuperato da: borace.com
- Fletcher Jenna. (14 gennaio 2019). Il borace è sicuro da usare? Recuperato da: MedicalNewstody.com
- « Struttura del cloruro di cromo (CRCL3), proprietà, usi
- Caratteristiche alimentari transgeniche, vantaggi, esempi, conseguenze »

