Storia di boro, proprietà, struttura, usi

- 659
- 133
- Enzo De Angelis
Lui boro È un elemento non metallico che si dirige il gruppo 13 della tavola periodica ed è rappresentato con il simbolo chimico B. Il suo numero atomico è 5 ed è l'unico elemento non metallico nel suo gruppo; Sebbene alcuni prodotti chimici lo considerano una metalloide.
È presentato come una polvere marrone nerastra ed è in una proporzione di 10 ppm in relazione alla crosta terrestre. Pertanto non è uno degli elementi più abbondanti.
 Campione boro con purezza circa il 99%. Fonte: Alajhasha [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)]
Campione boro con purezza circa il 99%. Fonte: Alajhasha [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] Fa parte di diversi minerali come borace o borato di sodio, questo è il minerale di boro più comune. Ci sono anche il kurnite, un'altra forma di borerata di sodio; Colemanite o borato di calcio; e l'ulettro, sodio e borato di calcio.
I Boratos sono estratti negli Stati Uniti, Tibet, Cina e Cile con una produzione mondiale di circa due milioni di tonnellate all'anno.
Questo elemento ha tredici isotopi, essendo il più abbondante undiciB, che costituisce l'80,1% del boro e il 10B, che costituisce il restante 19,9%.
Il boro è una traccia essenziale per le piante, che intervengono nella sintesi di alcune proteine delle piante vitali e contribuisce all'assorbimento dell'acqua. Nei mammiferi sembra necessario per la salute delle ossa.
Sebbene il boro sia stato scoperto nel 1808 dal chimico inglese Sir Humphry Davy e dai chimici francesi Jacques Thérnard e Joseph Gay-Lussac, dall'inizio della nostra epoca in Cina è stato usato nell'elaborazione della ceramica di Enamel.
Il boro e i suoi composti hanno molti usi e applicazioni, che vanno dal loro uso nella conservazione degli alimenti, in particolare alla margarina e al pesce, fino a quando l'uso nel trattamento dei tumori del cancro del cervello, della vescica, della prostata e di altri organi e altri organi e altri organi.
Il boro non è molto solubile in acqua, ma i suoi composti lo sono. Questo potrebbe essere un meccanismo di concentrazione del boro, nonché una fonte di avvelenamento con l'elemento.
[TOC]
Storia
Sfondo
Dal momento che l'uomo remoto ha usato i composti del boro in varie attività. El Borax, un minerale noto come Tincal, è stato usato in Cina in 300 giorni.C. nell'elaborazione della ceramica dello smalto.
L'alchimista persiano (865-925) fece la prima menzione dei composti boro. Rhazes ha classificato i minerali in sei classi, una delle quali erano le borocie che includevano il boro.
Agricola, intorno al 1600, ha riportato l'uso del borace come flusso in metallurgia. Nel 1777, fu riconosciuta la presenza di acido borico in una corrente di sorgenti calde vicino a Firenze.
Scoperta dell'elemento
Humphry Davy, attraverso l'elettrolisi di una soluzione di borace, ha osservato l'accumulo di un precipitato nero in uno degli elettrodi. Ha anche riscaldato l'ossido di boro (B2O3) Con potassio, producendo una polvere marrone nerastra che era la forma nota di boro.
Gay-Lussac e Thénard hanno ridotto l'acido borico ad alte temperature in presenza di ferro per produrre boro. Hanno anche mostrato il processo inverso, cioè dove l'acido borico è un prodotto dell'ossidazione del boro.
Identificazione e isolamento
Jöns Jakob Berzelius (1827) raggiunse l'identificazione di Boro come nuovo elemento. Nel 1892, il chimico francese Henri Moissan riuscì a produrre boro con purezza del 98%. Sebbene, si sottolinea che il boro è stato prodotto esclusivamente dal chimico americano Ezechiele Weintraub, nel 1909.
Proprietà
Descrizione fisica
Polvere amorfa solida o marrone nero cristallino.
Può servirti: perossidi: proprietà, nomenclatura, usi, esempiMassa molare
10.821 g/mol.
Punto di fusione
2076 ºC.
Punto di ebollizione
3927 ºC.
Densità
-Liquido: 2,08 g/cm3.
-Cristallino e amorfo a 20 ºC: 2,34 g/cm3.
Calore di fusione
50,2 kJ/mol.
Calore di vaporizzazione
508 kJ/mol.
Capacità calorica molare
undici.087 J/(mol · K)
Energia ionizzata
-Primo livello: 800.6 kj/mol.
-Secondo livello: 2.427 kJ/mol.
-Terzo livello: 3.659,7 kJ/mol.
Elettronegatività
2.04 su scala pauling.
Radio atomica
90 pm (empirico).
Volume atomico
4,16 cm3/mol.
Conduttività termica
27,4 w/m.K
Resistività elettrica
~ 106 Ω.M (a 20 ° C).
Le alte temperature il boro è un buon conduttore elettrico, ma a temperatura ambiente diventa quasi un isolante.
Durezza
~ 9.5 sulla scala MOHS.
Reattività
Il boro non è influenzato dall'acido cloridrico a temperatura di ebollizione. Tuttavia, viene convertito dall'acido nitrico caldo in acido borico (H3Bo3). Boro si comporta chimicamente come un non metal.
Reagisce con tutti gli alogeni per dare trihaluros, altamente reattivo. Questi hanno la formula generale BX3, Dove x rappresenta l'alogeno.
È combinato con diversi elementi per originare Boruros. Alcuni di loro sono tra le sostanze di maggiore durezza; Ad esempio, nitruro di boro (BN). Il boro è combinato con ossigeno per formare il triossido di boro.
Struttura e configurazione del boro elettronico
Collegamenti e unità strutturali in boro
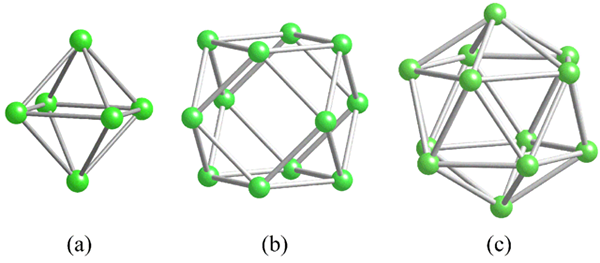 Geometrie delle unità strutturali comuni per boro. Fonte: MaterialScientist [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]
Geometrie delle unità strutturali comuni per boro. Fonte: MaterialScientist [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)] Prima di affrontare le strutture del boro (cristalline o amorfo) è essenziale tenere presente come i loro atomi possono essere collegati. Il collegamento B-B è in essenza covalente; Non solo, ma poiché naturalmente gli atomi di boro hanno una carenza elettronica, proveranno a fornirlo nei loro collegamenti in un modo o nell'altro.
Nel boro c'è un tipo speciale di legame covalente: quello di tre centri e due elettroni, 3C2E. Qui tre atomi di boro condividono due elettroni e definiscono un triangolo, una delle tante facce trovate nel loro polihedros strutturale (immagine superiore).
Da sinistra a destra abbiamo: Octaedro (a, b6), Cuboctaedro (B, B12) E isocasedro (c, b12 Anche). Tutte queste unità condividono una funzione: sono povere negli elettroni. Pertanto, devono collegarsi in modo covalente tra loro; E il risultato è una festa di collegamento sorprendente.
In ogni triangolo di questi polihedros è presente il collegamento 3C2E. Altrimenti, non si potrebbe spiegare come il boro, in grado di formare solo tre legami covalenti secondo la teoria dei collegamenti di Valencia, possa avere fino a cinque collegamenti in queste unità poliedriche.
Le strutture del boro consistono quindi in una disposizione e una ripetizione di queste unità che finiscono per definire un cristallo (o un solido amorfo).
Boro α-Romboédrico
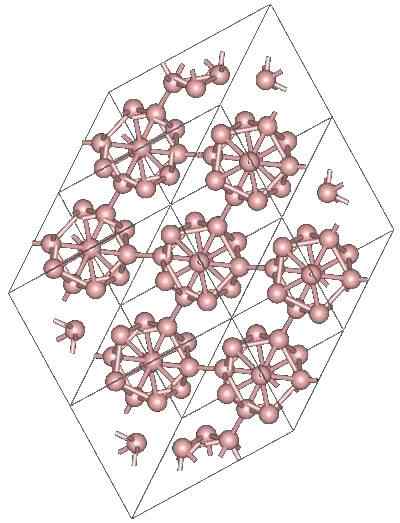 Struttura cristallina del boro α-romboédrico alotropico. Fonte: MaterialScientist presso l'inglese Wikipedia [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]
Struttura cristallina del boro α-romboédrico alotropico. Fonte: MaterialScientist presso l'inglese Wikipedia [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)] Potrebbero esserci altre unità poliedriche di boro, nonché un composto solo da due atomi, b2; Una "linea" di boro che deve essere collegata ad altri atomi a seguito della sua alta carenza elettronica.
L'icosaedro è di gran lunga l'unità preferita del boro; Quello che si sente meglio. Nell'immagine superiore, ad esempio, è apprezzato come queste unità B12 Si intrecciano per definire il cristallo romboedrico del boro-α.
Se uno di quei icosaedros volesse essere isolato, sarebbe un compito complicato, perché la loro carenza elettronica li costringe a definire un cristallo in cui ognuno fornisce gli elettroni di cui gli altri vicini hanno bisogno.
Β-romboédrico boro
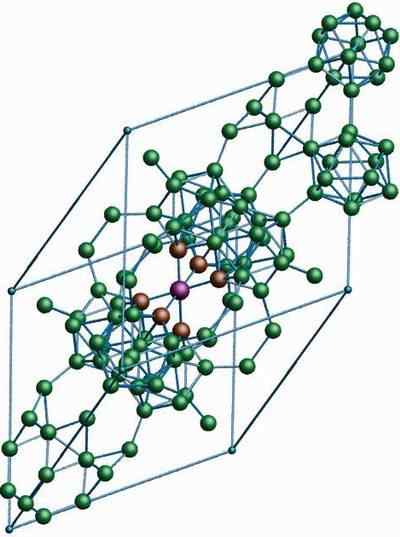 Struttura cristallina del boro β-romboédrico alotropico. Fonte: MaterialScientist presso l'inglese Wikipedia [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]
Struttura cristallina del boro β-romboédrico alotropico. Fonte: MaterialScientist presso l'inglese Wikipedia [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)] Il boro β-romboédrico alotropico, come già indica il nome, ha cristalli romboédica e boro-α; Tuttavia, differisce nelle sue unità strutturali. Sembra una nave extraterrestre fatta con atomi di boro.
Può servirti: idrossido di litio (Lioh)Se puoi vedere attentamente le unità icosaediche in modo discreto e unito (al centro). Ci sono anche unità B10 e atomi di boro solitari che fungono da ponte per le unità sopra menzionate. Di tutto, questo è il boro più stabile alotropo.
Gema boro-γ
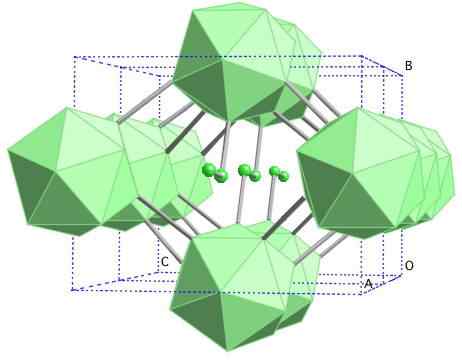 Struttura cristallina di boro-γ. Fonte: MaterialScientist presso l'inglese Wikipedia [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]
Struttura cristallina di boro-γ. Fonte: MaterialScientist presso l'inglese Wikipedia [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)] In questo boro alotropo, le unità B sono coordinate2 e B12. Il b2 presenta così tanta carenza elettronica che in realtà rimuove gli elettroni da b12 E esiste quindi un carattere ionico all'interno di questo solido. Cioè, non solo sono uniti covalentemente, ma c'è un tipo di attrazione elettrostatica [B2-] [B12+".
Boro-γ si cristallizza in una struttura di sale gema, lo stesso del NaCl. Sono ottenuti altri alotropi dal boro alle alte pressioni (20 GPa) e temperature (1800 ° C), quindi rimangono stabili in condizioni normali. La sua stabilità fattuale compete con quella di β-romboédrico boro.
Cubico e amorfo
Altri alotropi del boro consistono in aggregati di atomi B come se fossero uniti da un legame metallico o come se fossero cristalli ionici; cioè, è un boro cubico.
Inoltre, e non meno importante, è il boro amorfo, la cui disposizione di unità B12 È casuale e disordinato. È presentato come una polvere fine o vetrosa di colori scuri e marrone opaco.
Borofenos
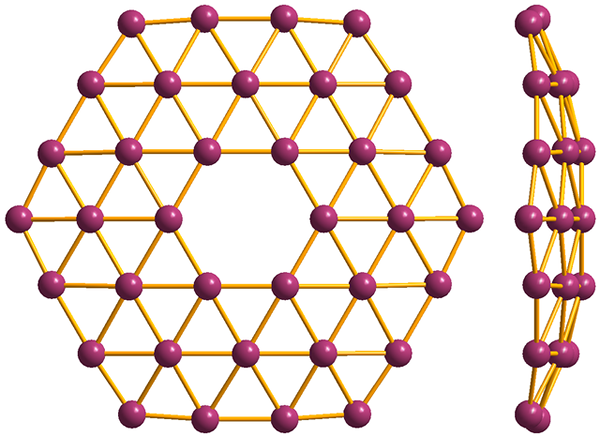 Struttura del più semplice dei borofenos, il B36. Fonte: MaterialScientist [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]
Struttura del più semplice dei borofenos, il B36. Fonte: MaterialScientist [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)] E infine è il più nuovo e bizzarro alotropico di Boro: Borofenos (Image Higher). È costituito da uno strato di scimmia di atomi di boro; estremamente sottile e analogo al grafene. Si noti che mantiene i famosi triangoli, caratteristici della carenza elettronica che i suoi atomi soffrono.
Oltre ai borofenos, di cui la b36 È il più semplice e piccolo, ci sono anche i cluster di Boro. Il borosferene (immagine sotto) è costituita da una gabbia sferica simile a una palla di quaranta atomi di boro, b40; Ma invece di avere bordi lisci, sono bruschi e irregolari:
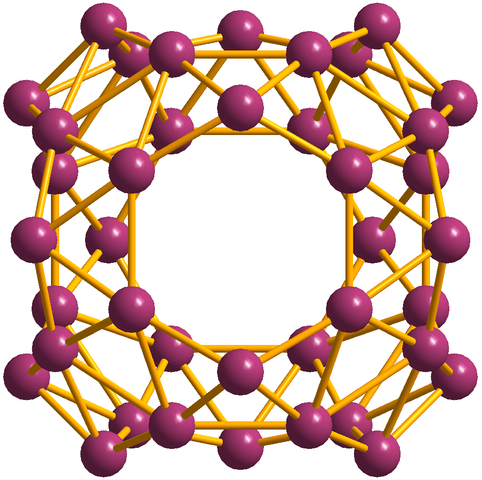 Unità di Borosferenos, B40. Fonte: MaterialScientist [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]
Unità di Borosferenos, B40. Fonte: MaterialScientist [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)] Configurazione elettronica
La configurazione elettronica del boro è:
[Lui] 2s2 2 p1
Pertanto, tre elettroni di Valencia. Gli mancano altri cinque per completare il suo otteto di Valencia e può appena formare tre legami covalenti; Avrei bisogno di un quarto link dativo per completare il tuo ottetto. Il boro può perdere i suoi tre elettroni per acquisire uno stato di ossidazione di +3.
Ottenimento
Il boro viene isolato riducendo l'acido borico con magnesio o alluminio; Metodo simile a Gay-Lussac e Thénard. Ha la difficoltà dell'inquinamento da boro con i boroos di quei metalli.
Un campione ad alta purezza può essere ottenuto mediante una riduzione gassosa del tricloruro di boro, o tribromuro, con idrogeno su filamenti riscaldati elettricamente.
Un boro ad alta purezza viene preparato mediante decomposizione ad alte temperature di diborano, seguita dalla purificazione mediante fusione di processi di zona o czacharalski.
Applicazioni
Nell'industria
Il boro elementare è stato usato nell'indurimento dell'acciaio. In lega con il ferro che contiene un boro compreso tra 0,001 e 0,005 %. Viene anche utilizzato nel settore non ferroso, di solito come desossidante.
Inoltre, il boro viene usato come fangoso in leghe a base di rame e rame ad alta conduttanza. Nell'industria dei semiconduttori, piccole quantità di boro vengono aggiunte come agente doping di silicio e germanio.
Può servirti: isopreno: struttura, proprietà, applicazioniOssido di boro (B2O3) è miscelato con silice per creare un vetro resistente al calore (vetro borosilicato), utilizzato negli utensili da cucina e in alcune attrezzature di laboratorio.
Carburo di boro (B4C) È una sostanza estremamente dura che viene utilizzata come agente abrasivo e di rinforzo nei materiali compositi. Aluminio Boruro (Alb12) È usato come sostituto della polvere di diamante per glassata e lucidata.
Il boro è usato in leghe, ad esempio nei magneti delle terre rare, in lega con ferro e neodimio. I magneti formati sono utilizzati nella produzione di microfoni, interruttori magnetici, cuffie e acceleratori di particelle.
In medicina
La capacità dell'isotopo boro-10 (10B) Per catturare i neutroni, emettendo radiazioni di tipo α è stata utilizzata per il trattamento dei tumori cerebrali in una tecnica nota come terapia di cattura dei neutroni di boro (BNCT).
Lui 10B sotto forma di composti viene accumulato nel tumore canceroso. Successivamente, la zona tumorale con neutroni è irradiata. Questi interagiscono con 10B, cosa causa l'emissione di particelle α. Queste particelle hanno un elevato effetto biologico relativo e per le loro grandi dimensioni hanno poca portata.
Quindi l'azione distruttiva delle particelle α è limitata nelle cellule tumorali, eseguendo la loro distruzione. BNCT è anche usato nel trattamento di tumori di collo, fegato, vescica e prostata.
Azione biologica
È necessaria una piccola quantità di acido borico o boro a forma di borerazione per la crescita di molte piante. Una carenza di boro si manifesta nella crescita deformata delle piante; il "cuore marrone" delle verdure; e il "marciume secco" della barbabietola da zucchero.
Il boro può essere necessario in piccole quantità per mantenere la salute delle ossa. Ci sono studi che indicano che la mancanza di boro sarebbe coinvolta nella generazione di artrite. Interrogerebbe anche nelle funzioni cerebrali come la memoria e il coordinamento eye-man.
Alcuni esperti sottolineano che da 1,5 a 3 mg di boro dovrebbero essere inclusi nella dieta quotidiana.
Rischi e cautela
Boro, ossido di boro, acido borico e boratos, sono considerati non tossici. L'LD50 per gli animali è 6 g di boro/kg di peso corporeo, mentre le sostanze con un LD50 superiori a 2 g/kg di peso corporeo sono considerate non tossiche.
D'altra parte, il consumo di oltre 0,5 mg/giorno di boro per 50 giorni provoca piccoli problemi digestivi, indicativo di tossicità. Alcuni rapporti sottolineano che un eccesso di assunzione di boro può influire sul funzionamento dello stomaco, del fegato, dei reni e del cervello.
Allo stesso modo, sono stati indicati effetti irritanti a breve termine nel rinofaringe, nel tratto respiratorio superiore e negli occhi per l'esposizione al boro.
Le relazioni sulla tossicità del boro sono scarse e in molti casi la tossicità è presentata a dosi molto elevate, superiore alla popolazione generale è esposta.
La raccomandazione è di monitorare il contenuto di boro del cibo, in particolare verdure e frutta. Le agenzie sanitarie governative devono monitorare che la concentrazione di boro idrico non supera i limiti consentiti.
I lavoratori esposti alla polvere contenente il boro dovrebbero indossare maschere che proteggono il tratto respiratorio, i guanti e gli stivali speciali.
Riferimenti
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Wikipedia. (2019). Allotropi di boro. Recuperato da: in.Wikipedia.org
- Prof. Robert J. Lancashire. (2014). Conferenza 5b. Struttura degli elementi (non metalli, b, c). Il Dipartimento di Chimica, Università delle Indie occidentali, Campus Mona, Kingston 7, Giamaica. Recuperato da: Chem.Uwimona.Edu.Jm
- Manisha Lalloo. (28 gennaio 2009). Struttura del boro ultra-pure scoperto. Mondo chimico. Recuperato da: Chemistryworld.com
- Bell Terence. (16 dicembre 2018). Un profilo del boro metallico. Recuperato da: thebelance.com
- I redattori di Enyclopedia Britannica. (2019). BORO. Recuperato da: Britannica.com
- Agenzia per sostanze tossiche e registro delle malattie. (2010). Toxfaqs ™ su boro. [PDF]. Estratto da: ATSDR.Centro per la prevenzione e il controllo delle malattie.Gov
- Helmestine, Anne Marie, PH.D. (6 febbraio 2019). Boron Chemical & Physical Properties. Recuperato da: Thoughtco.com

