Storia dello zolfo, proprietà, struttura, ottenimento, usi

- 3769
- 952
- Cosetta Messina
Lui zolfo È un elemento non metallico che conduce, sotto l'ossigeno, il gruppo di calcogeni nella tabella periodica. Si trova specificamente nel gruppo 16 con il periodo 3 ed è rappresentato con i simboli chimici s. Dei suoi isotopi naturali, il 32S sta dormendo molto (circa il 94% di tutti gli atomi di zolfo).
È uno degli elementi più abbondanti sulla Terra, componendo circa il 3% della sua massa totale. Vale a dire che se tutto lo zolfo del pianeta fosse stato preso, si potevano costruire due lune gialle; Ci sarebbero tre satelliti invece di uno. Può adottare diversi stati di ossidazione (+2, -2, +4 e +6), quindi i loro sali sono numerosi e arricchiscono la corteccia terrestre e il nucleo.
 Cristalli di zolfo. Fonte: Pixabay.
Cristalli di zolfo. Fonte: Pixabay. Lo zolfo è sinonimo di giallo, cattivi odori e inferno. Il motivo principale dei suoi cattivi odori è dovuto ai suoi composti derivati; Soprattutto gassoso e organico. Del resto, i loro minerali sono solidi e hanno colori che includono giallo, grigio, bianco e nero (tra gli altri).
È uno degli elementi che presenta la maggior parte di un ampio numero di alotropi. Può essere trovato come molecole piccole e discrete di S2 o s3; come anelli o cicli, essendo ortorrombico e zolfo monoclino8 il più stabile e abbondante di tutti; e come catene elicoidali.
Non solo si trova nella corteccia terrestre sotto forma di minerali, ma anche nelle matrici biologiche dei nostri corpi. Ad esempio, è nelle proteine di cistina, cisteina e metionina, nelle proteine di ferro, cheratina e vitamine. È presente anche in aglio, pompelmi, cipolle, cavoli, broccoli e cavolflo.
Chimicamente è un elemento morbido e in assenza di ossigeno forma minerali e solfati di zolfo. Brucia con una fiamma bluastra e può essere mostrata come un solido amorfo o cristallino.
Nonostante sia indispensabile per la sintesi di acido solforico, sostanza altamente corrosiva e assegnare odori spiacevoli, in realtà è un elemento benigno. Lo zolfo può essere immagazzinato in qualsiasi spazio senza gravi precauzioni, purché si evitano gli incendi.
[TOC]
Storia di zolfo
Nella Bibbia
Lo zolfo è uno degli elementi più antichi nella storia dell'umanità; Tanto che la sua scoperta è incerta e non si sa quale delle antiche civiltà la usasse per la prima volta (4000 anni prima di Cristo). Nelle stesse pagine della Bibbia puoi trovarlo accompagnando il fuoco infernale e i guasti.
Si ritiene che il presunto odore dell'inferno abbia a che fare con le eruzioni vulcaniche. Il suo primo scopritore doveva sicuramente imbattersi in miniere di questo elemento mentre la polvere atterra o cristalli gialli nelle vicinanze di un vulcano.
Antichità
Questo solido giallastro ha presto dimostrato notevoli effetti di guarigione. Ad esempio, gli egiziani hanno usato lo zolfo per trattare le infiammazioni delle palpebre. Ha anche alleviato la scabbia e l'acne, un'applicazione che oggi può essere vista in saponi di zolfo e altri oggetti dermatologici.
I romani usavano questo elemento nei loro rituali, come fumigante e sbiancamento. Quando Librara Sos2, Gas che inondò le stanze che si mescolavano con umidità e fornendo un mezzo antibatterico e in grado di annientare gli insetti.
I romani, come i Greci, hanno scoperto l'elevata combustibilità dello zolfo, quindi è diventato sinonimo di fuoco. Il colore delle sue fiamme bluastre doveva illuminare i circhi romani. Si ritiene che i Greci, nel frattempo, usassero questo elemento per creare armi incendiarie.
I cinesi dalla loro parte hanno appreso che mescolando lo zolfo con la salsa (kno3) e il carbone ha creato la polvere da sparo nera che ha pagato un turnover storico e che ha suscitato nelle nazioni di allora grandi richieste e interesse per questo minerale.
Può servirti: Cironium: storia, proprietà, struttura, rischi, usiTempi moderni
Come se la polvere da sparo non fosse un motivo sufficiente per desiderare lo zolfo, l'acido solforico e le applicazioni industriali sono presto emerse. E con la bacchetta di acido solforico, è stata misurata la quantità di ricchezza o prosperità di un paese in relazione ai suoi livelli di consumo di questo composto.
Fu solo nel 1789 quando il brillante chimico Antoine Lavoisier fu in grado di riconoscere lo zolfo e classificarlo come elemento. Quindi, nel 1823 il chimico tedesco Eilhard Mitscherlich scoprì che lo zolfo può cristallizzarsi prevalentemente in due modi: romboédrica e monoclinica.
La storia dello zolfo ha seguito lo stesso canale dei suoi composti e applicazioni. Con l'enorme importanza industriale dell'acido solforico, ha accompagnato la vulcanizzazione delle gomme, la sintesi della penicillina, lo sfruttamento delle miniere, la raffinazione di petrolio di zolfo, l'alimentazione del suolo, ecc.
Proprietà
Aspetto fisico
Brezza solida in polvere o cristalli. Il suo colore è giallo limone opaco, è insipido e manca di odore.
Aspetto liquido
Lo zolfo liquido è singolare perché il suo colore giallo iniziale diventa rossastro e si intensifica e si scurisce se subisce alte temperature. Quando brucia, dire fiamme blu e luminose.
Massa molare
32 g/mol.
Punto di fusione
115.21ºC.
Punto di ebollizione
445ºC.
punto di accensione
160ºC.
Temperatura di auto -Identizione
232ºC.
Densità
2,1 g/ml. Tuttavia, altri alotropi possono essere meno densi.
Capacità termica molare
22,75 J/mol · K
Radio covalente
105 ± 3 pm.
Elettronegatività
2,58 sulla scala Pauling.
Polarità
I collegamenti S-S sono apolari perché entrambi gli atomi di zolfo hanno la stessa elettronegatività. Questo rende tutti i suoi alotropi, ciclici o sotto forma di catene, apolare; E quindi, le sue interazioni con l'acqua sono inefficienti e non possono essere solubilizzate in esso.
Tuttavia, lo zolfo può essere sciolto in solventi apolari come disolfuro di carbonio, CS2, e aromatico (benzene, toluene, xilene, ecc.).
Ioni
Lo zolfo può formare diversi ioni, generalmente anioni. Il più noto di tutti è il solfuro, s2-. La s2- È caratterizzato dall'essere ingombrante e da una base morbida di Lewis.
Per essere una base morbida, la teoria stabilisce che tende a formare composti con acidi morbidi; Come i cationi di transizione, compresa la fede2+, Pb2+ e Cu2+.
Struttura elettronica e configurazione
La corona di zolfo
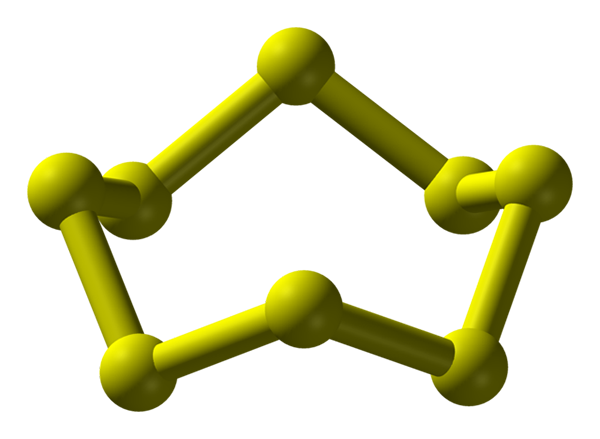 Molecola S8, la più stabile e abbondante alotropica di zolfo. Fonte: Benjah-BMM27.
Molecola S8, la più stabile e abbondante alotropica di zolfo. Fonte: Benjah-BMM27. Lo zolfo può verificarsi in un'ampia varietà di alotropi; e questi a loro volta hanno strutture cristalline che vengono modificate in diverse pressioni e/o temperature. Pertanto, lo zolfo è un elemento ricco in alotropos e polimorfi e lo studio delle sue strutture solide rappresenta una fonte infinita di opere teoriche-sperimentali.
Perché tale complessità strutturale? Per cominciare, i legami covalenti nello zolfo (S-S) sono molto forti, essendo superati solo da carbonio, C-C e idrogeno, H-H.
Lo zolfo, a differenza del carbonio, non tende a formare tetraedri ma boomerang; che con i loro angoli si piegano e squillano per stabilizzare le catene di zolfo. L'anello più noto di tutti, che rappresenta anche il più stabile alotropico dello zolfo, è la s8, La "corona di zolfo" (immagine superiore).
Si noti che tutti i collegamenti S-S8 Sembrano singoli boomerang, risultando in un anello con pieghe e piatti. Queste corone s8 Interagiscono attraverso le forze di Londra, orientate in modo tale che riescano a creare modelli strutturali che definiscono un cristallo ortorrombico; chiamato s8 α (S-α o semplicemente zolfo ortorrombico).
Può servirti: materiali elasticiPolimorfi
La corona di zolfo è uno dei tanti alotropi per questo elemento. La s8 α è un polimorfo di questa corona. Ce ne sono altri due (tra i più importanti) chiamati s8 β e s8 γ (S-β e S-γ, rispettivamente). Entrambi i polimorfi si cristallizzano nelle strutture monocliniche, essendo la s8 γ è più denso (gamma di zolfo).
I tre sono solidi gialli. Ma come viene ottenuto ogni polimorfo separatamente?
La s8 β prepara la s8 α a 93 ° C, quindi consentendo il suo raffreddamento lento per rallentare la transizione di ritorno alla fase ortorrombica (α). E la s8 γ, d'altra parte, si ottiene quando si basa8 α a 150 ° C, permettendo di nuovo di raffreddare lentamente; È il più denso dei polimorfi della corona di zolfo.
Altri alotropi ciclici
La corona s8 Non è l'unico alotropo ciclico. Ci sono altri come S4, S5 (Analogico al ciclopentano), s6 (rappresentato da un esagono e dal ciclo), s7, S9, e s10-20; Quest'ultimo significa che possono esserci anelli o cicli che contengono da dieci a venti atomi di zolfo.
Ognuno di essi rappresenta diversi alotroch ciclici di zolfo; E a sua volta, per sottolinearlo, hanno varietà di polimorfi o strutture polimorfiche che dipendono dalla pressione e dalla temperatura.
Ad esempio, la s7 Ha fino a quattro polimorfi noti: α, β, γ e Δ. I membri o le corone di masse molecolari più alte sono prodotti di sintesi organica e non predominano in natura.
Catene di zolfo
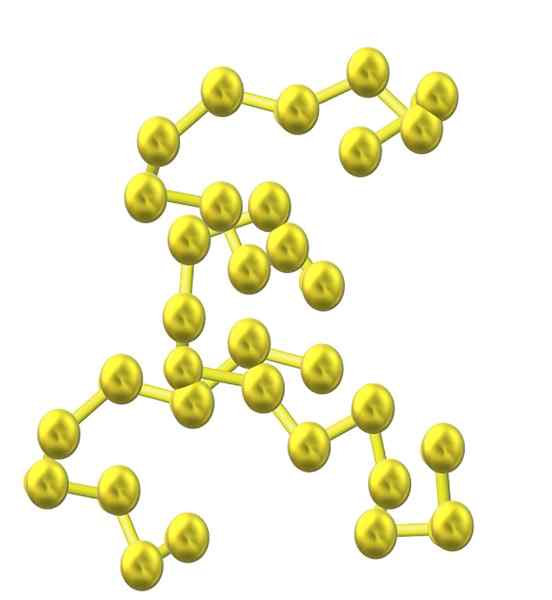 Catena di zolfo. Fonte: Opentax [CC di 4.0 (https: // creativeCommons.Org/licenze/by/4.0)]
Catena di zolfo. Fonte: Opentax [CC di 4.0 (https: // creativeCommons.Org/licenze/by/4.0)] Poiché più atomi di zolfo sono incorporati nella struttura, la loro tendenza a suonare diminuisce e le catene di zolfo rimangono aperte e adottano conformazioni elicoidali (come se fossero spirali o viti).
E quindi, si presenta un'altra voluminosa famiglia di allotrops di zolfo che non consiste in anelli o cicli ma di catene (come l'immagine superiore).
Quando queste catene S-S si allineano in parallelo al vetro, catturano impurità e finiscono per definire un solido fibroso chiamato zolfo fibroso o S-ψ. Se tra queste catene parallele ci sono legami covalenti che li interconnettono (come con la vulcanizzazione della gomma), abbiamo lo zolfo laminare.
Quando lo zolfo s8 Scioglie una fase liquida giallastra che può diventare buio se la temperatura è aumentata. Questo perché i collegamenti S-S sono rotti e quindi si verificano un processo di depolimerizzazione termica.
Questo liquido quando si raffredda mostra caratteristiche di plastica e poi vetroso; cioè si ottengono uno zolfo vitreo e amorfo (S-Ser). La sua composizione è costituita da entrambi gli anelli e le catene di zolfo.
E quando una miscela di alotropo fibroso e laminario si ottiene dallo zolfo amorfo, un prodotto commerciale utilizzato per la vulcanizzazione della gomma.
Piccoli Alotropi
Sebbene siano lasciati per l'ultima volta, non sono meno importanti (o interessanti) degli alotropos delle masse molecolari più grandi. S2 e s3 sono le versioni solfurizzate di O2 IO3. Nei primi due atomi di zolfo, si uniscono a un doppio legame, s = s, e nel secondo ci sono tre atomi con strutture di risonanza, s = s-s.
Entrambi i s2 come la s3 Sono gassosi. La s3 Manifestare una colorazione rossa ciliegia. I due hanno abbastanza materiale bibliografico per coprire ciascuno un singolo articolo.
Configurazione elettronica
La configurazione elettronica per l'atomo di zolfo è:
[Ne] 3s2 3p4
Puoi guadagnare due elettroni per completare il tuo otteto di Valencia e quindi avere uno stato di ossidazione di -2. Allo stesso modo, puoi perdere elettroni, a partire da due nei suoi orbitali 3p, essendo il suo stato di ossidazione di +2; Se perdi altri due elettroni, con i tuoi Orbitali 3P vuoti, lo stato di ossidazione sarà +4; E se perdi tutti gli elettroni, sarà +6.
Può servirti: metalloidiOttenere dove si trova lo zolfo?
Mineralogico
Lo zolfo fa parte di molti minerali. Tra questi ci sono la pirite (Fes2), La Galena (PBS), Covellita (CUS) e altri minerali di solfato e solfuri. Elaborandoli, non solo i metalli possono essere estratti, ma anche lo zolfo dopo una serie di reazioni riduttive.
Può anche essere ottenuto puramente in prese d'aria vulcaniche, dove quando la temperatura viene sollevata e si riversa in discesa; E se dà fuoco, sembrerà una lava bluastra. Attraverso un lavoro arduo e opere fisiche faticose, lo zolfo può essere raccolto in quanto è stato fatto abbastanza frequentemente in Sicilia.
Lo zolfo può anche essere trovato nelle miniere sotterranee, che sono fatte per pompare l'acqua di surriscaldamento per scioglierlo e trasferirla in superficie. Questo processo di ottenimento è noto come processo Brasch, attualmente poco utilizzato.
Petrolio
Oggi la maggior parte dello zolfo proviene dall'industria petrolifera, poiché i suoi composti organici fanno parte della composizione del petrolio petrolio e dei suoi raffinati derivati.
Se un greggio o un prodotto raffinato è ricco di zolfo e subisce idrodesolfurizzazione, rilascerà grandi quantità di H2S (gas puzzolente che ha un odore di uova marce):
R-S-R + 2 H2 → 2 rh + h2S
Poi h2S È chimicamente nel processo di Clauss, riassunto con le seguenti equazioni chimiche:
3 o2 + 2 h2S → 2 SO2 + 2 h2O
SW2 + 2 h2S → 3 s + 2 h2O
Applicazioni
Alcuni degli usi per lo zolfo sono menzionati di seguito e in generale:
- È un elemento essenziale sia per le piante che per gli animali. È persino presente in due aminoacidi: cisteina e metodo.
- È la materia prima per l'acido solforico, composta nella preparazione di innumerevoli prodotti commerciali.
- Nell'industria farmaceutica è destinato alla sintesi dei derivati dello zolfo, la penicillina è la più conosciuta degli esempi.
- Consente la vulcanizzazione delle gomme interconnessibili con le catene polimeriche con collegamenti S-S.
- Il suo colore giallo e le miscele con altri metalli lo rendono desiderabile nel settore dei pigmenti.
- Mescolato con una matrice inorganica, come sabbia e rocce, asfalto di cemento e zolfo è preparato per la sostituzione del bitume.
Rischi e precauzioni
Lo zolfo da solo è una sostanza innocua e non tossica e rappresenta anche potenziali rischi, a meno che non reagisca per formare altri composti. I suoi sali di solfato non sono pericolosi e possono essere manipolati senza gravi precauzioni. Ciò non accade, tuttavia, con i suoi derivati gassosi: così2 e h2S, entrambi estremamente tossici.
Se è in una fase liquida, può causare gravi ustioni. Se inghiottente in grandi quantità, h può innescare2S nell'intestino. Per il resto, non rappresenta alcun rischio per coloro che masticano.
In termini generali lo zolfo è un elemento sicuro che non richiede troppe precauzioni, tranne tenerlo lontano dal fuoco e forti agenti ossidanti.
Riferimenti
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Laura Crapanzano. (2006). Polimorfismo dello zolfo: aspetti strutturali e dinamici. Fisica [fisica].Università Joseph -fourier - Grenoble i. Inglese. FFTEL-00204149F
- Wikipedia. (2019). Altropi di zolfo. Recuperato da: in.Wikipedia.org
- Meyer Beat. (1976). Zolfo elementare. Recensioni chimiche, vol. 76, n. 3.
- Dottore. Doug Stewart. (2019). Fatti per elementi di zolfo. Chemicool. Recuperato da: Chemicool.com
- Donald W. Davis e Randall a. Detro. (2015). Storia dello zolfo. Georgia Gulf Sulphur Corporation. Recuperato da: georgiagulfsulfur.com
- Helmestine, Anne Marie, PH.D. (11 gennaio 2019). 10 fatti di zolfo interessanti. Recuperato da: Thoughtco.com
- Boone, c.; Bond, c.; Hallman, a.; Jenkins, J. (2017). Scheda di fatti di zolfo generale; National Pesticide Information Center, Oregon State University Extension Services. NPIC.Orst.Edu
- « Indipendenza dalle cause del Messico, sviluppo, conseguenze, personaggi
- Flora e fauna delle specie rappresentative di Jalisco »

