Storia di arsenico, struttura, proprietà, usi

- 1188
- 356
- Baldassarre Ross
Lui arsenico È un semimetale o metalloide che appartiene al gruppo 15 o va dalla tavola periodica. È rappresentato dal simbolo chimico come e ha il numero atomico 33. Può essere sotto tre forme altropi: giallo, nero e grigio; Quest'ultimo è l'unico con importanza industriale.
L'arsenico grigio è un solido metallico, fragile, con un colore d'acciaio e cristallino (Image inferiore). Perde la sua luminosità quando esposta all'aria che forma l'ossido di arsenioso (come2O3), che quando riscaldato emette un odore di aglio. D'altra parte, i suoi alotrochos gialli e neri sono molecolari e amorfi, rispettivamente.
 Arsenico metallico. Fonte: immagini ad alta risoluzione degli elementi chimici [CC di 3.0 (https: // creativeCommons.Org/licenze/di/3.0)]
Arsenico metallico. Fonte: immagini ad alta risoluzione degli elementi chimici [CC di 3.0 (https: // creativeCommons.Org/licenze/di/3.0)] L'arsenico si trova nella crosta terrestre associata a numerosi minerali. Solo una piccola proporzione è in uno stato nativo, tuttavia associata ad antimonio e argento.
Tra i minerali più comuni in cui gli arsenici sono i seguenti sono: Rejalgar (come4S4), l'oropiment (come2S3), Loellingita (brutto2) e l'enargita (cu3Culo4). L'arsenico è anche ottenuto come prodotto collaterale della fonderia di metalli come piombo, rame, cobalto e oro.
I composti arsenici sono tossici, in particolare Arsina (Ash3). Tuttavia, l'arsenico ha numerose applicazioni industriali, tra cui la lega con piombo, utilizzate nell'elaborazione delle batterie per auto e la lega con il gallio con diversi usi in elettronica.
[TOC]
Storia della tua scoperta
Il nome "arsenico" deriva dall'arsenico latino e dall'arsenikon greco, riferendosi all'oropiment gialla, che costituiva la forma principale di utilizzo dell'arsenico da parte degli alchimisti.
L'arsenico molto prima di essere riconosciuto come elemento chimico, era noto e usato sotto forma dei suoi composti. Ad esempio, Aristotele nel IV secolo.C. Ha scritto del sandarache, una sostanza che ora si pensa che fosse il solfuro di arsenico.
Plinio El Viejo e Pivanio Discorisides, nel I secolo.C., Hanno descritto l'oropiment, un minerale costituito da2S3. Nell'XI secolo, furono riconosciute tre specie di arsenico: bianco (come4O4), Il giallo (come2S3) e rosso (come4S4).
L'arsenico come elemento puro, è stato osservato per la prima volta da Albertus Magnus (1250). Solfuro di arsenico riscaldato Magnus con sapone, notando l'aspetto di una sostanza con una caratteristica simile all'immagine grigia -gray dell'immagine. Tuttavia, il primo rapporto autentico del suo isolamento fu pubblicato nel 1649 da Johann Schroeder, un farmacista tedesco.
Schroeder ha preparato l'arsenico riscaldando il suo ossido di carbone. Successivamente, Nicolas Lémery è riuscita a riscaldarlo riscaldando una miscela di ossido di arsenico, sapone e potassa. Nel 18 ° secolo, questo elemento fu finalmente riconosciuto come un semimetico.
Può servirti: nessun elettroliti: caratteristiche ed esempiStruttura arsenica
L'arsenico è isomorfo per l'antimonio; Questo è, strutturalmente sono identici, differiscono solo nelle dimensioni dei loro atomi. Ogni atomo di arsenico forma tre legami covalenti come-as, in modo tale da originare anche unità esagonali6 "Rugoso o ripido", poiché l'ibridazione di AS atomi è SP3.
Quindi le unità6 Si collegano dando origine a ripidi strati di arsenico, che interagiscono debolmente tra loro. Seguendo le loro forze intermolecolari, principalmente dipendenti dalle loro masse atomiche, i cristalli romnenici di arsenico grigio danno al solido una trama fragile e fragile.
Forse a causa delle repulsioni degli elettroni arsenici, le unità6 Formato tra strati paralleli non definiscono un ottaedro perfetto ma distorto:
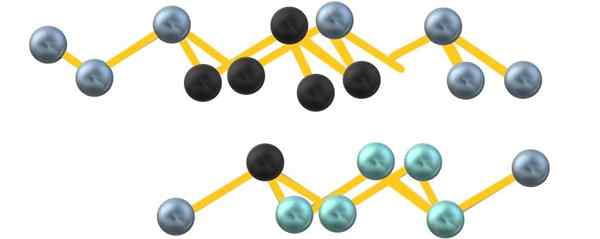 Struttura cristallina di arsenico grigio. Fonte: Gabriel Bolívar.
Struttura cristallina di arsenico grigio. Fonte: Gabriel Bolívar. Si noti che le sfere nere disegnano il piano distorto nello spazio tra due strati ripidi. Inoltre, nel livello sottostante ci sono sfere bluastre che, accanto alla sfera nera, compongono l'unità6 menzionato all'inizio della sezione.
La struttura sembra ordinata, le file si alzano e scendono, e quindi è cristallina. Tuttavia, puoi diventare amorfo, con sfere spremute di modi diversi. Quando l'arsenico grigiastro diventa amorfo, diventa un semiconduttore.
Arsenico giallo
L'arsenico giallo, il più tossico alotropico di questo elemento, è un solido semplicemente molecolare. È costituito da molecole come molecole4 unità da forze di dispersione deboli, che non impediscono loro di volatilizzare.
Arsenico nero
L'arsenico nero è amorfo; Ma non come può essere l'alotropo grigiastro. La sua struttura è leggermente simile al recente6 Hanno aree maggiori e diversi modelli di disturbo.
Configurazione elettronica
[AR] 3D104s24p3
Ha tutti gli orbitali di livello 3 pieno. Formare collegamenti utilizzando gli orbitali 4S e 4p (oltre a 4D) da diverse ibridazioni chimiche.
Proprietà
Peso molecolare
74.922 g/mol
Descrizione fisica
L'arsenico grigio è una coerenza solida e fragile metallica grigiastra.
Colore
Tre forme allotropiche, giallo (alfa), nero (beta) e grigio (gamma).
Odore
Gabinetto
Gusto
Insapore
Punto di fusione
1.090 K a 35,8 atm (Triple Arsenic Point).
Alla pressione normale non ha un punto di fusione, poiché sublima 887 K.
Densità
-Arsenico grigio: 5,73 g/cm3.
Può servirti: gruppo carbonile: caratteristiche, proprietà, nomenclatura, reattività-Arsenico giallo: 1,97 g/cm3.
Solubilità dell'acqua
Insolubile
Radio atomica
139 pm
Volume atomico
13,1 cm3/mol
Radio covalente
120 pm
Calore specifico
0,328 J/g · mol a 20 ºC
Calore di evaporazione
32,4 kJ/mol
Elettronegatività
2,18 sulla scala Pauling
Energia ionizzata
Prima energia di ionizzazione 946,2 kJ/mol
Stati di ossidazione
-3, +3, +5
Stabilità
L'arsenico elementare è stabile nell'aria secca, ma quando è esposto all'aria umida, è coperto da uno strato di bronzo giallo che può diventare uno strato nero di ossido di arsenico (2O3).
Decomposizione
Quando l'arsenico viene riscaldato alla decomposizione, emette un fumo bianco da come2O3. La procedura è pericolosa perché anche l'Arsina può essere emessa, un gas molto velenoso.
Auto-direzione
180 ºC
Durezza
3.5 sulla scala della durezza MOHS.
Reattività
Non viene attaccato da acido solforico freddo o acido cloridrico concentrato. Reagisce con acido nitrico o acido solforico caldo, formando acido arseno e acido arsenico.
Quando l'arsenico grigio viene volatilizzato dal riscaldamento e i vapori vengono rapidamente raffreddati, si forma un arsenico giallo. Questo ritorna alla forma grigiastra, se sottoposto a luce ultravioletta.
Applicazioni
Leghe
Una piccola quantità di arsenico aggiunto al piombo, indurisce le sue leghe abbastanza da usarle nel rivestimento dei cavi e nell'elaborazione delle batterie per auto.
L'aggiunta di arsenico all'ottone, una lega di rame e zinco, aumenta la sua resistenza alla corrosione. D'altra parte, corregge o riduce la perdita di zinco in ottone, il che provoca un aumento della sua vita utile.
elettronica
L'arsenico purificato viene utilizzato nella tecnologia dei semiconduttori dove viene utilizzato in combinazione con Gallic.
I GAA hanno un intervallo di banda diretta, che può essere utilizzato nella produzione di diodi, laser e LED. Oltre all'arseniuro di gallio ci sono altri arseniuros, come l'arseniuro indiano e l'arseniuro di alluminio, che costituiscono anche semiconduttori II-V.
Nel frattempo, il cadmio arseniuro è un semiconduttore del tipo II-IV. L'Arsina è stata utilizzata nel doping a semiconduttore.
Agricoltura e conservazione del legno
La maggior parte delle applicazioni sono state scartate a causa della loro grande tossicità e di quella dei loro composti. L'as2O3 è stato usato come pesticida, mentre l'asso2O5 È un ingrediente di erbicidi e insetticidi.
Acido arsenico (h3Aso4) e sali come il calcio e l'arsenato di piombo, sono stati usati per sterilizzare i terreni e controllare i parassiti. Ciò genera un rischio di inquinamento ambientale con arsenico.
Può servirti: elementi liquidi: cosa sono ed esempiL'Arseniato di piombo è stato usato come insetticida negli alberi da frutto, fino alla prima metà del ventesimo secolo. Ma a causa della sua tossicità, è stato sostituito dal metilarsenato di sodio, che ha smesso di essere usato per lo stesso motivo dal 2013.
Medicinale
Fino al ventesimo secolo molti dei loro composti furono usati come medicine. Arsfenamina e Neolsalvarsan, per esempio, sono stati usati nel trattamento della sifilide e della triposomiasi.
Nel 2000, l'uso dell'AS è stato approvato2O3, Composto molto tossico, nel trattamento dell'acido acido acido retino-resistente alla promozione acuta. Recentemente, è stato utilizzato l'isotopo radioattivo 74Per quanto riguarda la posizione dei tumori.
L'isotopo produce buone immagini, più chiare di quelle ottenute con 124Io, perché lo iodio è portato alla tiroide e produce rumore nel segnale.
Altri usi
L'arsenico è stato usato in passato come mangime additivo nella produzione di pollame e maiali.
È usato come catalizzatore nella produzione di ossido di etilene. È anche usato in pirotecnici e abbronzatura. L'ossido di arsenioso è usato come decolorante nella produzione di vetro.
Dove si trova?
L'arsenico può essere trovato in piccole quantità in uno stato elementare, con un alto grado di purezza. È presente in numerosi composti, come: solfuri, arsenuros e solfarseniuros.
Si trova anche in diversi minerali, tra cui: arsenopirite (Fesas), loellingita (brutto2), l'enargita (Cu3Culo4), l'oropiment (come2S3) E rejalgar (come4S4).
Come si ottiene?
L'arsenopirita è riscaldato a 650-700 ºC, in assenza di aria. L'arsenico evapora, lasciando il solfuro di ferro (FES) come residuo. Durante questo processo, l'arsenico si lega all'ossigeno alla forma4O6, noto come "arsenico bianco".
L'as4O6 È modificato per formare l'AS2O3, i cui vapori sono raccolti e condensati in una serie di telecamere in mattoni, purificando l'arsenico mediante sublimazione.
La maggior parte dell'arsenico viene prodotta riducendo il carbonio della polvere formata2O3.
Riferimenti
- Stephen r. Marsden. (23 aprile 2019). Chimica dell'arsenico. Chimica librettexts. Recuperato da: Chem.Librettexts.org
- Helmestine, Anne Marie, PH.D. (3 dicembre 2018). Fatti interessanti sull'arsenico. Recuperato da: Thoughtco.com
- Wikipedia. (2019). Arsenico. Recuperato da: in.Wikipedia.org
- Dottore. Impasto Stewart. (2019). Fatti per elementi arsenici. Chemicool. Recuperato da: Chemicool.com
- Royal Society of Chemistry. (2019). Arsenico. Recuperato da: RSC.O
- I redattori di Enyclopedia Britannica. (3 maggio 2019). Arsenico. Encyclopædia Britannica. Recuperato da: Britannica.com
- « Caratteristiche gruppi di minoranza, tipi, esempi
- Reynolds Numero a cosa serve, come viene calcolato, esercitazioni »

