Antraceno cosa è, struttura, proprietà, usi
- 2424
- 260
- Dante Morelli
Lui Antracene È un idrocarburo aromatico policiclico (PAH) che è formato dalla fusione di tre anelli di benzene. È un composto incolore, ma sotto l'irradiazione della luce ultravioletta acquisisce un colore blu fluorescente. L'antracene si sublima facilmente.
È un solido bianco, ma può anche verificarsi come cristalli incolori incolori, di odore aromatico morbido. L'antracene solido è praticamente insolubile nell'acqua ed è parzialmente solubile in solventi organici, specialmente nel disolfuro di carbonio, CS2.
Fu scoperto nel 1832 da August Laurent e Jean Dumas, usando il catrame come materia prima. Questo materiale continua ad essere utilizzato nella produzione di antracene, poiché contiene l'1,5 % del composto aromatico. Può anche essere sintetizzato dal benzochinone.
Si trova nell'ambiente come un prodotto della combustione parziale di idrocarburi fossili. È stato trovato nell'acqua potabile, nell'aria atmosferica, nelle fughe dei veicoli a motore e nel fumo delle sigarette. Appare nell'elenco EPA (Agenzia per la protezione ambientale degli Stati Uniti) dei più importanti inquinanti ambientali.
Struttura antracene
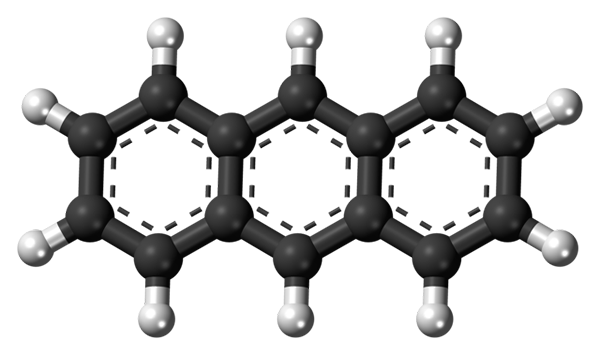 I tre anelli aromatici di antracene. Fonte: Jynto [CC0]
I tre anelli aromatici di antracene. Fonte: Jynto [CC0] L'immagine superiore mostra la struttura dell'antracene rappresentato con un modello di sfere e barre. Come si può vedere, ci sono tre anelli aromatici a sei carbonio; Questi sono anelli di benzene. Le linee tratteggiate indicano l'aromaticità presente nella struttura.
Tutti i carboni hanno ibridazione SP2, Quindi la molecola è sullo stesso piano. Pertanto, l'antracene può essere considerato un foglio piccolo e aromatico.
Si noti che gli atomi di idrogeno (sfere bianche) sono praticamente scoperti di fronte a una serie di reazioni chimiche.
Forze intermolecolari e struttura cristallina
Antracen. Ad esempio, puoi vedere che due di questi "fogli" si uniscono e muovono gli elettroni della loro nuvola π (i centri aromatici degli anelli), riescono a stare insieme.
Un'altra possibile interazione è che gli idrogeni, con un certo carico parziale positivo, sono attratti dai centri negativi e aromatici delle molecole di antract vicine. E quindi, queste attrazioni esercitano un effetto direzionale che guidano le molecole antracene nello spazio.
Può servirti: costante di velocitàPertanto, l'antracene è ordinato in modo tale da adottare un modello di struttura a lungo raggio; E quindi, può cristallizzare in un sistema monoclino.
Presumibilmente, questi cristalli mostrano un prodotto di colorazione giallastra della loro ossidazione ad Antraquinona; che deriva da antracene il cui solido è giallo.
Proprietà
Nomi chimici
-Antracene
-Paranaftalene
-Antracina
-Olio verde
Formula molecolare
C14H10 o (c6H4Ch)2.
Peso molecolare
178.234 g/mol.
Descrizione fisica
Solido bianco o giallo pallido. Cristalli monoclinici Prodotto della ricristallizzazione nell'alcool.
Colore
Quando è puro l'antracene è incolore. Con cristalli gialli gialli gialli danno fluorescenza di un colore blu. Puoi anche presentare alcuni toni giallastri.
Odore
Aromatico morbido.
Punto di ebollizione
341,3 ºC.
Punto di fusione
216 ºC.
punto di accensione
250 ºF (121 ºC), tazza chiusa.
Solubilità dell'acqua
Praticamente insolubile in acqua.
0.022 mg/L di acqua a 0 ºC
0044 mg/L di acqua a 25 ° C.
Solubilità dell'etanolo
0,76 g/kg a 16ºC
3,28 g/kg a 25 ° C. Nota come è più solubile in etanolo che in acqua alla stessa temperatura.
Solubilità in Hexano
3,7 g/kg.
Solubilità in benzene
16,3 g/l. La sua più grande solubilità in benzene mostra la sua alta affinità per lui, poiché entrambe le sostanze sono aromatiche e cicliche.
Solubilità disolfuro di carbonio
32,25 g/l.
Densità
1,24 g/cm3 a 68 ºF (1,25 g/cm3 a 23 ° C).
Densità del vapore
6,15 (con l'aria presa come riferimento pari a 1).
Pressione del vapore
1 mmHg a 293 ºF (Sublima). 6.56 x 10-6 MMHG a 25 ºC.
Stabilità
È stabile se conservato nelle condizioni consigliate. È triboluminescente e triboelettrico; Ciò significa che emette luce ed elettricità quando si strofina. L'antracene si oscura quando esposto alla luce solare.
Auto-direzione
1.004 ºF (540 ºC).
Decomposizione
Vengono prodotti composti pericolosi per combustione (ossidi di carbonio). Si decompone quando riscaldato sotto l'influenza di forti ossidanti, producendo un acro e fumo tossico.
Può servirti: nitrobenzene (C6H5N2): struttura, proprietà, usi, rischiCalore a combustione
40.110 kJ/kg.
Capacità calorica
210,5 J/mol · K.
Lunghezza d'onda di assorbimento massima (luce visibile e ultravioletta)
Massimo λ 345,6 nm e 363,2 nm.
Sostanza vischiosa
-0,602 cpoise (240 ºC)
-0,498 cpoise (270 ºC)
-0,429 cpoise (300 ° C)
Come si può vedere, la sua viscosità diminuisce all'aumentare della temperatura.
Nomenclatura
Antracen è una molecola policicica uniforme e, secondo la nomenclatura stabilita per questo tipo di sistema, il suo vero nome dovrebbe essere tricen. Il prefisso TRI è dovuto al fatto che ci sono tre anelli di beancenic. Tuttavia, il nome banale antracene si è esteso e radicato nella cultura popolare e scientifica.
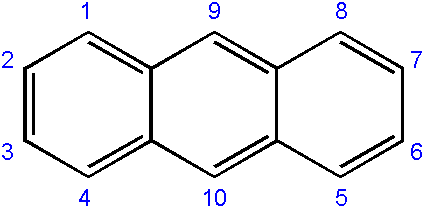
La nomenclatura dei composti derivati da esso è generalmente un po 'complessa e dipende dal carbonio in cui si verifica la sostituzione. Quanto segue mostra la rispettiva numerazione di carboni per Antract:
 Numerazione di carboni nell'antracene. Fonte: Edgar181 [dominio pubblico]
Numerazione di carboni nell'antracene. Fonte: Edgar181 [dominio pubblico] L'ordine di numerazione è dovuto alla priorità di reattività o suscettibilità di tali carboni.
I carboni delle estremità (1-4 e 8-5) sono i più reattivi, mentre quelli nel mezzo (9-10), reagiscono attraverso altre condizioni; Ad esempio, ossidativo, per formare l'antraquinone (9, 10-diossontracene).
Tossicità
In contatto con la pelle può causare irritazione, prurito e bruciore, che peggiora con la luce solare. Anthracen è fotosensibilizzatore, che migliora il danno della pelle causato dalle radiazioni UV. Può causare dermatite acuta, teangiectasia e allergia.
In contatto con gli occhi può causare irritazione e bruciare. Respirare l'antracene può irritare il naso, la gola e i polmoni, causando tosse e respiro sibilante.
L'assunzione di antracene è stata associata all'uomo con mal di testa, nausea, perdita di appetito, infiammazione del tratto gastrointestinale, reazioni lente e debole.
Ci sono stati suggerimenti di un'azione per il cancro di antracene. Tuttavia, questa presunzione non è stata confermata, compresi alcuni derivati antraceni sono stati utilizzati nel trattamento di alcuni tipi di cancro.
Applicazioni
Tecnologico
-Antracen è un semiconduttore organico, usato come spinfer in fotoni ad alta energia, elettroni e particelle alfa.
-Viene anche usato per il rivestimento di plastica, come il polivinilluene. Questo al fine di produrre spindle di plastica, con caratteristiche simili all'acqua, per usarlo nella dosimetria della radioterapia.
Può servirti: Piperidina: struttura, sintesi, derivati, reazioni-L'antracene è comunemente usato come plotter di radiazione UV, applicato in rivestimenti nei circuiti stampati. Ciò consente di ispezionare il rivestimento con luce ultravioletta.
Molecola standal
Nel 2005 i chimici dell'Università della California, Riverside, hanno sintetizzato la prima molecola standard: 9.10-ditioantratone. Questo viene spinto in linea retta quando viene riscaldato su una superficie rame piatta e può muoversi come se avesse due piedi.
I ricercatori hanno pensato che la molecola fosse potenzialmente utilizzabile nel calcolo molecolare.
Piezococromaticità
Alcuni derivati antracene hanno proprietà piezochromatiche, cioè hanno la capacità di cambiare colore a seconda della pressione applicata. Pertanto, possono essere usati come rilevatori di pressione.
L'antracene è anche usato nell'elaborazione degli schermi di fumo così chiamati.
Ecologico
Politica I idrocarburi aromatici (PAH) sono inquinanti ambientali, principalmente dall'acqua, quindi vengono compiuti sforzi per ridurre la presenza tossica di questi composti.
Antracen è un materiale (PAH) e viene utilizzato come modello, per studiare l'applicazione del metodo della pirolisi dell'acqua nella degradazione dei composti PAH.
La pirolisi dell'acqua viene utilizzata nel trattamento delle acque industriali. La sua azione sull'antracene ha prodotto la formazione di composti di ossidazione: antrron.
Questi prodotti sono meno stabili dell'antracene e quindi sono meno persistenti nell'ambiente, essendo in grado di essere più facilmente eliminati rispetto ai composti PAH.
Altri
-L'antracene si ossida per originare l'antrino, usato nella sintesi di coloranti e coloranti
-L'antracene viene utilizzato nella protezione del legno. Viene anche usato come insetticida, ictus, erbicida e raticide.
-L'antibiotico antraciclina è stato usato in chemioterapia, poiché inibisce la sintesi di DNA e RNA. La molecola di antraciclina è intervallata tra le basi DNA/RNA, inibendo la replicazione delle cellule tumorali in rapida crescita.
Riferimenti
- Antracene. Recuperato da: in.Wikipedia.org
- Antracene. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov

