Amidas
- 4023
- 33
- Enzo De Angelis
Spieghiamo quali sono le loro caratteristiche, la loro struttura, i tipi, la nomenclatura e diamo diversi esempi
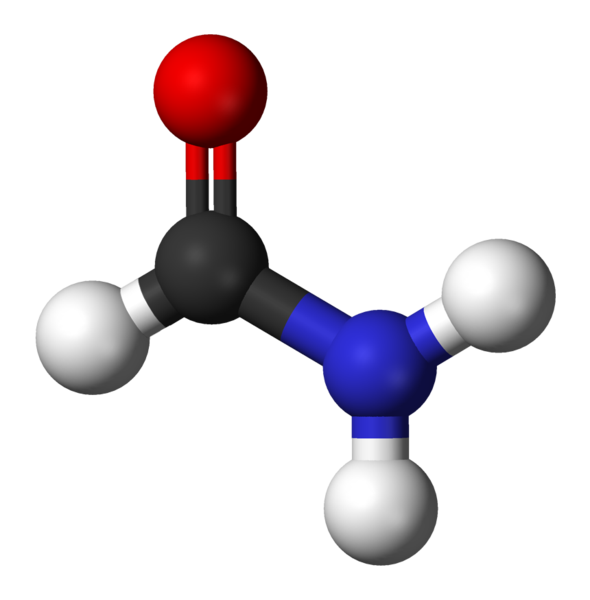
 Formamide, la più semplice Amida
Formamide, la più semplice Amida Quali sono gli Amidas?
Gli amidas sono un tipo di composti organici che sono formati dall'unione tra un acido carbossilico e un'ammina. Sono anche chiamati ammine acidi e da lì è proprio da dove viene la parola Amide.
Questi composti sono molto importanti per la vita, poiché sono una parte essenziale di proteine, peptidi e alcuni ormoni. Fanno anche parte delle basi azotate di DNA e RNA, che contengono le nostre informazioni genetiche.
Amidas sono anche molto importanti nel settore. Per esempio, Il nylon È una delle fibre sintetiche più utilizzate in tutto il mondo ed è formata da una lunga catena di Amides United una dopo l'altra.
Inoltre, le ammidi sono usate molto nell'industria farmaceutica, poiché fanno parte di medicinali come la lidocaina.
Caratteristiche delle ammidi
- Quasi tutti sono solidi: Tutte le ammidi sono solide a temperatura ambiente, tranne la più piccola e semplice che è la formamide. Quest'ultimo è liquido.
- Hanno un punto di ebollizione elevato: Rispetto agli acidi carbossilici e alle ammine da cui sono realizzati, le amidi hanno un punto di ebollizione elevato. Ad esempio, acetamide (scegli3Conh2) È formato dall'unione di acido acetico (aceto) con ammoniaca. Il punto di ebollizione dell'acetamide è 221,2 ºC, mentre quello dell'acido acetico è di 118 ºC e l'ammoniaca è -33,34 ºC.
- Alcuni sono solubili in acqua: I più piccoli Amidas si mescolano bene con l'acqua, quindi è facile dissolverli al suo interno. Tuttavia, man mano che diventano più grandi, diventano meno solubili.
- Sono meno basilari delle ammine: Un Amida è sempre meno semplice (o più acido) rispetto all'ammina da cui proviene. In effetti, il nome Amida viene dalla combinazione MeNa+acidà.
- Il tuo link è facilmente rotto: Se viene aggiunta una base forte come catalizzatore, le Amidi reagiscono rapidamente con l'acqua. Questa reazione è chiamata idrolisi e allo stesso modo, l'amida è rotta per formare l'acido originale e l'ammina.
- Sono incolori e servizi igienici: In generale, le ammidi sono sostanze che non hanno un colore o odore caratteristico.
Struttura del gruppo funzionale
Chimicamente, l'Amida è un gruppo funzionale che contiene un gruppo carbonilico (C = O) da un acido carbossilico, collegato all'azoto di ammoniaca o ammina. La struttura generale delle ammidi è:
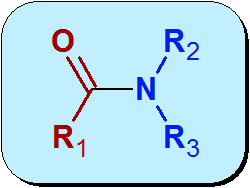 La parte rossa della molecola nell'immagine precedente proviene dall'acido carbossilico e viene chiamata Acile. La parte blu viene dall'Amida.
La parte rossa della molecola nell'immagine precedente proviene dall'acido carbossilico e viene chiamata Acile. La parte blu viene dall'Amida.
Una caratteristica della struttura degli AMI che li distingue dalle ammine, è che la coppia di elettroni liberi che l'azoto la possiede con il gruppo carbonile attraverso un processo chiamato risonanza. Questo è ciò che rende gli iMI meno semplici delle ammine.
Tipi di ammidi
A seconda che l'acido sia combinato con l'ammoniaca, con un'amina primaria o con un'ammina secondaria, è possibile ottenere tre tipi di ammidi con strutture diverse:
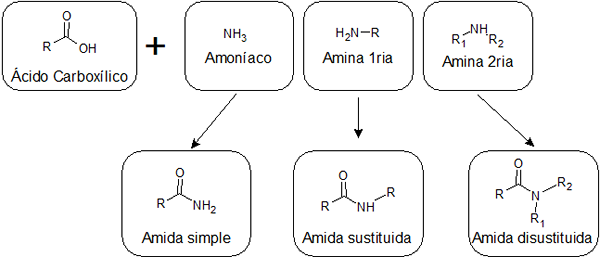
Amide semplice
Sono formati dall'unione tra un acido carbossilico e l'ammoniaca. Questo tipo di amida ha un gruppo -nh2 Collegato al gruppo carbonilico. Le amide semplici possono formare diversi legami idrogeno tra loro e con acqua, quindi di solito sono più solubili di quelli sostituiti.
- Semplici esempi di Amida: formamide, acetamide e butiramide.
Sostituito da Amides
Sono ottenuti dall'unione di un acido e un'ammina primaria. In questo caso, uno degli idrogeni di -nh2 Delle semplici ammidi sono sostituite da un alchil, ed è per questo che viene detto sostituiti.
- Esempio di Amide sostituita: Il legame tra aminoacidi nelle proteine.
Amidi non ribelle
Vengono dalla reazione tra un acido e un'ammina secondaria. In questo caso, entrambi gli idrogeni del gruppo -nh2 Sono sostituiti da gruppi alchilici. Le ammidi in disaccordo non hanno idrogeno attaccato ai nitrogeni, quindi non possono formare ponti idrogeno tra loro e solo uno debole con acqua. Questo li rende meno solubili in acqua rispetto agli altri tipi di ammidi.
Lactamas, primario, secondario e terziario Amidas
Oltre ai tre tipi di ammidi appena citate, ci sono anche Amide primarie, secondarie e terziarie, Ciò differisce avendo uno, due o tre gruppi acidi uniti all'atomo di azoto.
Infine, alcune ammidi formano cicli chiusi. In questo caso, il composto è chiamato lattame. I lattami sono molto importanti in natura. Ad esempio, l'uracile che fa parte dell'RNA, è un lactam.
Nomenclatura di Amidas
Amide semplice
Le amide semplici sono chiamate dal nome della catena di carbonio dell'acido da cui provengono (la catena principale). Il nome è costruito posizionando il prefisso indicando il numero di carboni (methan-, bulan-, esan-, ecc.) o il nome comune dell'acido rimuovendo la terminazione -OICO o -ico (come in AcétICO) E aggiungendo la risoluzione -amida.
- Esempio: l'ammide che proviene dall'acido acetico è chiamata acetamide e quella che viene dall'acido propanóico è chiamata propanamide.
Amide sostituite e disabili
In questo caso, inizia nominando i gruppi alchilici che sono uniti all'azoto, preceduti dalla lettera N-. Quindi il resto dell'Amida è nominato la catena principale.
Può servirti: zolfo: storia, proprietà, struttura, ottenimento, usiEsempio:
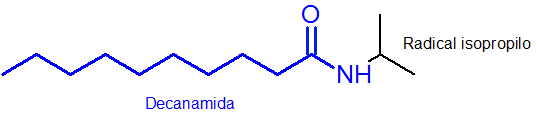 Come si può vedere, il sostituente che è attaccato all'azoto è un gruppo isopropilico, quindi è incluso nel nome come n-osopropil (l'ultimo "O" viene sempre rimosso al nome del radicale).
Come si può vedere, il sostituente che è attaccato all'azoto è un gruppo isopropilico, quindi è incluso nel nome come n-osopropil (l'ultimo "O" viene sempre rimosso al nome del radicale).
Il resto della catena principale, che ha il gruppo funzionale Amida, ha 10 atomi di carbonio. Cioè, il tuo nome deve avere il prefisso decan-seguito dalla risoluzione di Amida o, decanamide. Così lui Il nome completo è n-osopropilcanamide.
Esempi di ammidi
- Benzamide c6H5Conh2
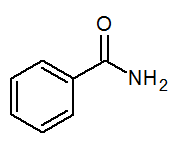
- N, N-dimetilacetamide CH3Con (ch3)2
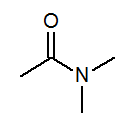
- Acetamide ch3Conh2
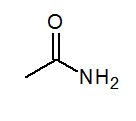
- Fenilacetamide (c6H5) Ch2Conh2
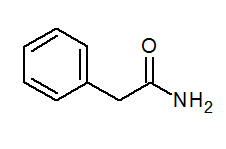
- N-butil-n-propilformamide HCON (C3H7) (C4H9)
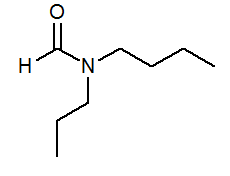
- 4-idrossibanamide ch2(Oh) Cho2Cap2Conh2
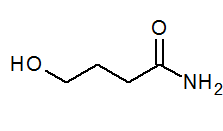
- Urea co (NH2)2
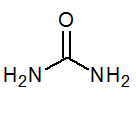
- Propanamide ch3Cap2Conh3
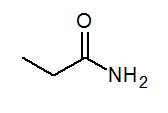
- N-butil-2-echopilpetanamida ch3Cap2Cap2Ch (c3H7) Conh (C4H9)

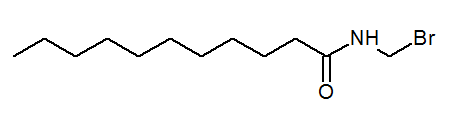
- N- (bromometil) undecanamide Cho3(Ch2)9Conhch2Br
Riferimenti
- Britannica, t. Redattori di Encyclopedia (2019, 15 maggio). Amide. Britannica Enciclopedia. Preso da Britannica.com
- Amis-strutture e nomi. (2020, 17 agosto). Tratto da Chem.Librettexts.org
- Carey, f. A. (2008). Chimica organica. Boston: McGraw-Hill Higher Education.
- Smith, m., Marzo, j., & Marzo, j. (2001). La chimica organica avanzata di marzo: reazioni, meccanismi e strofini. New York: Wiley.
- Zabicky, J. (1970). La chimica dell'AMI, parte 1. New York: Wiley

