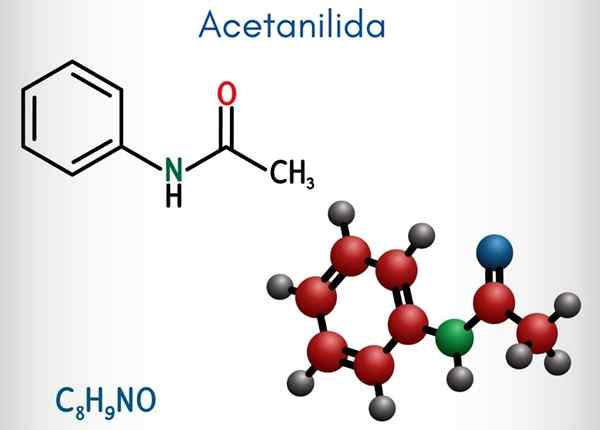
Acetanilide (C8H9NO)
- 775
- 132
- Benedetta Rinaldi
Cos'è l'acetanilide?
IL acetanilide (C8H9No) È un'ammide aromatica che riceve diversi nomi aggiuntivi: N-acetilarilamina, N-Fenilacetamide e Atetanil. È presentato come un bagno solido sotto forma di fiocchi, la sua natura chimica è Amida e come tale può formare gas infiammabili quando reagisce con forti agenti riducenti.
Inoltre, è una base debole, essere in grado di reagire con agenti disidratanti come P2O5 Per avere origine un nitrile. Si è scoperto che l'acetanilide aveva un'azione analgesica e antipiretica ed era usata nel 1886 con il nome di Antifebrin da a. Cahn e p. Hepp.
Nel 1899, l'acido acetilsalicilico (aspirina) fu introdotto sul mercato, che aveva le stesse azioni terapeutiche dell'acetanilide. Quando l'uso dell'acetanilide è correlato alla comparsa di cianosi nei pazienti - una conseguenza della metemoglobinemia indotta dall'acetanilide - il suo uso è stato scartato.
Successivamente è stato stabilito che l'azione analgesica e antipiretica dell'acetanilide risiedeva in un metabolita di questo paracetamolo così chiamato (acetoaminofene), che non aveva i suoi effetti tossici, come suggerivano Axelrod e Brodie.
Struttura chimica

Nell'immagine superiore è rappresentata la struttura chimica dell'acetanilide. A destra è l'anello aromatico esagonale del benzene (con linee tratteggiate) e la sinistra è il motivo per cui il composto è costituito da un amida aromatico: il gruppo acetamide (HNCOCH3).
Il gruppo di acetamide dà all'anello di benzene un carattere polare maggiore; Cioè, crea un momento di dipolo nella molecola atetanolide.
Perché? Poiché l'azoto è più elettronegativo di qualsiasi atomi di carbonio dell'anello ed è anche legato al gruppo acilico, il cui atomo di o attira anche la densità elettronica.
Può servirti: uretano: struttura, proprietà, ottenimento, usiD'altra parte, quasi l'intera struttura molecolare dell'acetanilide poggia sullo stesso piano a causa dell'ibridazione SP2 degli atomi che lo compongono.
C'è un'eccezione legata a quelle del gruppo -CH3, i cui atomi di idrogeno costituiscono i vertici di un tetraedro (le sfere bianche dell'estremità sinistra lasciano il piano).
Strutture di risonanza e interazioni intermolecolari
La coppia solitaria senza condividere l'atomo di N circola attraverso il sistema π dell'anello aromatico, originando diverse strutture di risonanza. Tuttavia, una di queste strutture termina con il carico negativo nell'atomo di O (più elettronegativo) e un carico positivo nell'atomo di n.
Pertanto, ci sono strutture di risonanza in cui un carico negativo si muove nell'anello e un altro in cui risiede nell'atomo di o. Come conseguenza di questa "asimmetria elettronica", che deriva dalla mano dell'asimmetria molecolare-L'acetanilide interagisce in modo intermolecolare dalle forze dipolo-dipolo.
Tuttavia, le interazioni di idrogeno ponte (n-h-o-…) tra due molecole di acetanolide sono, in effetti, la forza predominante nella sua struttura cristallina.
In questo modo, i cristalli di acetanilide sono costituiti da cellule unità ortorrombiche di otto molecole orientate con forme di "nastri piatti" dai loro ponti idrogeno.
Quanto sopra può essere visualizzato se una molecola di acetanilide è posizionata sopra l'altra, in parallelo. Quindi, come i gruppi HNCOCH3 Si sovrappongono spaziali, formano ponti idrogeno.
Inoltre, tra queste due molecole può anche "essere rubato" un terzo, ma con il suo anello aromatico che punta sul lato opposto.
Può servirti: blu bromotimolProprietà chimiche di acetanilide
 Aspetto appello
Aspetto appello Peso molecolare
135.166 g/mol.
Descrizione chimica
Solido bianco o grigiastro. Formare fiocchi bianchi brillanti o una polvere bianca cristallina.
Odore
Gabinetto.
Gusto
Leggermente piccante.
Punto di ebollizione
304 ºC a 760 mmHg (579 ºF a 760 mmHg).
Punto di fusione
114,3 ºC (237,7 ºF).
Flash o infiammabilità
169 ºC (337 ºF). Misurazione in vetro aperto.
Densità
1.219 mg/ml a 15 ° C (1.219 mg/ml a 59 ºF)
Densità del vapore
4.65 con relazione aerea.
Pressione del vapore
1 mmHg a 237 ºF, 1,22 × 10-3 mmHg a 25 ºC, 2a a 20 ° C.
Stabilità
Soffre di un rango chimico quando esposto alla luce ultravioletta. Come cambia la struttura? Il gruppo acetile forma nuovi collegamenti nell'anello nelle posizioni orto e per. Inoltre, è stabile in aria e incompatibile con forti agenti ossidanti, caustici e alcali.
Volatilità
Apprezzabilmente volatile a 95 ºC.
Autorezione
1004 ºF.
Decomposizione
Si decompone quando riscaldato, emettendo un fumo altamente tossico.
ph
5 - 7 (10 g/L di H2O 25 ºC)
Solubilità
- In acqua: 6,93 × 103 mg/ml a 25 ° C.
- 1 g di solubilità di acetanilide in diversi liquidi: in 3,4 ml di alcool, 20 ml di acqua bollente, 3 ml di metanolo, 4 ml di acetone, 0,6 ml di alcool bollente, 3,7 ml di cloroformio, 5 ml di gliecerol, 8 ml di diossano, 47 ml di benzene e 18 etere. L'idrato di cloral aumenta la solubilità dell'acetanilide in acqua.
Sintesi
È sintetizzato reagendo l'anidride acetica con acetanilide. Questa reazione appare in molti testi di chimica organica (Vogel, 1959):
C6H5NH2 + (Ch3CO)2O => c6H5Nhcoch3 + Cap3COOH
Può servirti: borace: storia, struttura, proprietà, usi, sintesi, rischiApplicazioni
- È un agente inibitore del processo di decomposizione del perossido di idrogeno (perossido di idrogeno).
- Stabilizzare le vernici dell'estere di cellulosa.
- Interviene come intermediario nell'accelerazione della produzione di gomma. Allo stesso modo, è intermediario nella sintesi di alcuni coloranti e la canfora.
- Funge da precursore nella sintesi della penicillina.
- È usato nella produzione di cloruro a 4-acetamidefonilbenzene. L'acetanilide reagisce con l'acido clorosolfonico (HSO3Cl), producendo così il cloruro di 4-aminosulfonilbenzene. Questo reagisce con ammonio o un'ammina organica primaria per formare i sulfonamidi.
- È stato usato sperimentalmente nel diciannovesimo secolo nello sviluppo della fotografia.
- L'acetanilide è usato come marcatore di flussi elettroosmotici (EOF) nell'elettroforesi capillare per lo studio del legame tra farmaci e proteine.
- Recentemente, 1- (ω-fenossialkiluracilo) si è unito all'inibizione negli esperimenti di inibizione degli esperimenti di inibizione del virus dell'epatite C. L'acetanilide si unisce alla posizione 3 dell'anello di pirimidina.
- I risultati sperimentali indicano una riduzione della replicazione del genoma virale, indipendentemente dal genotipo virale.
- Prima di identificare la tossicità dell'acetanilide, è stato usato come analgesico e antipiretico dal 1886. Successivamente (1891), fu usato nel trattamento della bronchite cronica e acuta da Grün.