Ossido di boro (B2O3) cosa è, struttura, proprietà, usi
- 3294
- 813
- Dott. Rodolfo Gatti
Lui ossido di boro o L'anidride borica è un composto inorganico la cui formula chimica è b2O3. Essendo elementi di boro e ossigeno del blocco P della tavola periodica e ancora più capi dei rispettivi gruppi, la differenza di elettronegatività tra loro non è molto alta; Pertanto, si prevede che la B2O3 essere di natura covalente.
Il b2O3 Viene preparato dissolvendo il borace in acido solforico concentrato all'interno di un forno di fusione e ad una temperatura di 750 ° C; Acido borico disidratante termicamente, b (OH)3, ad una temperatura di circa 300 ° C; oppure può anche essere formato come prodotto della reazione di Diborano (B2H6) Con ossigeno.
L'ossido di boro può avere un aspetto di vetro semi -trasparente o cristallino; Quest'ultimo mediante macinazione può essere ottenuto in forma di polvere.
Sebbene non sembri prima vista, la B è considerata2O3 come uno degli ossidi inorganici più complessi; Non solo da un punto di vista strutturale, ma anche a causa delle proprietà variabili che il vetro e la ceramica acquisiscono a cui vengono aggiunti alla loro matrice.
Struttura dell'ossido di boro
Unity Bo3
Il b2O3 È un solido covalente, quindi in teoria non esistono nella sua struttura ione B3+ né2-, Ma collegamenti B-O. Il boro, secondo la teoria dei collegamenti di Valencia (TEV), può formare solo tre collegamenti covalenti; In questo caso, tre collegamenti B-O. Di conseguenza, la geometria prevista deve essere trigonale, Bo3.
La molecola Bo3 Sono elettroni poveri, in particolare atomi di ossigeno; Tuttavia, molti di loro possono interagire tra loro per fornire detta carenza. Quindi, i triangoli bo3 Si uniscono condividendo un ponte di ossigeno e sono distribuiti nello spazio come reti di file triangolari con i loro aerei orientati in modi diversi.
Può servirti: soluzione insaturaStruttura cristallina
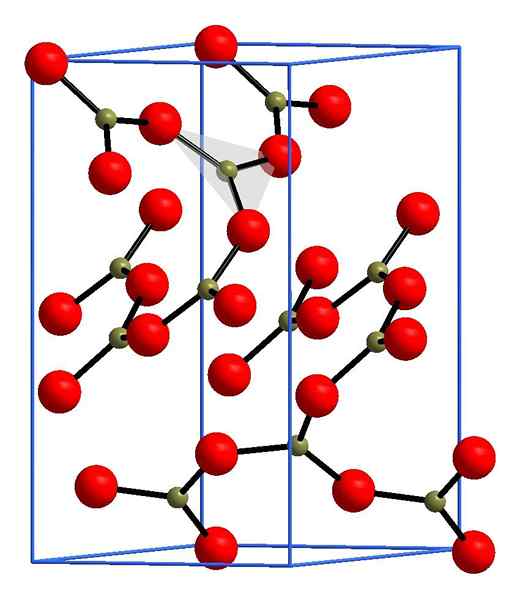
 Struttura dell'ossido di boro. Andif1, Wikimedia Commons.
Struttura dell'ossido di boro. Andif1, Wikimedia Commons. Nell'immagine superiore un esempio di queste file con unità triangolari Bo3. Se viene osservato attentamente, non tutti i volti dei piani indicano il lettore, ma dall'altra parte. Gli orientamenti di questi volti possono essere responsabili di come B è definito2O3 A una certa temperatura e pressione.
Quando queste reti hanno un modello strutturale a lungo raggio, è un solido cristallino, che può essere costruito dalla sua cella unitaria. Qui è dove si dice che la b2O3 Ha due polimorfi cristallini: α e β.
L'α-B2O3 Viene prodotto a pressione ambientale (1 atm) e si dice che sia cineticamente instabile; In effetti, questo è uno dei motivi per cui l'ossido di boro è probabilmente un composto di cristallizzazione difficile.
L'altro polimorfo, β-b2O3, Le alte pressioni sono ottenute nell'intervallo GPA; Pertanto, la sua densità deve essere maggiore di quella di α-b2O3.
Struttura vitrea
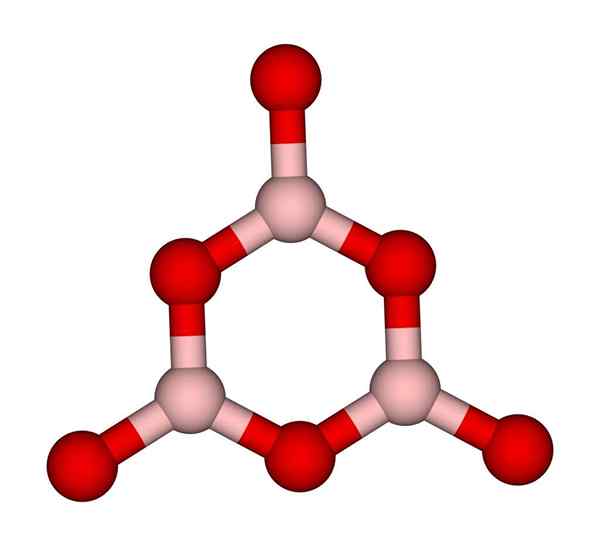 Anello boroxol. Ccoil (talk). Wikimedia Commons.
Anello boroxol. Ccoil (talk). Wikimedia Commons. Reti bo3 naturalmente tendono ad adottare strutture amorfe; Questi sono, che mancano di un modello che descrive le molecole o gli ioni nel solido. Sintetizzando la b2O3 La sua forma predominante è amorfa e non la cristallina; In parole corrette: è un solido più vitreo che cristallino.
Si dice quindi che il B2O3 È vitreo o amorfo quando i tuoi ragazzi di Bo3 Sono disordinati. Non solo questo, ma cambia anche il modo in cui si uniscono. Invece di ordinare in una geometria trigonale, un anello boroxol (immagine superiore) finisce per creare i ricercatori (immagine superiore).
Può servirti: 20 esempi di energia chimicaNota l'ovvia differenza tra unità triangolari ed esagonali. Triangolare caratterizza b2O3 cristallino ed esagonale a B2O3 vitreo. Un altro modo per riferirsi a questa fase amorfa è il vetro boro o per mezzo di una formula: G-B2O3 (Il 'G' proviene dalla parola vetrosa, in inglese).
Pertanto, reti G-B2O3 Sono composti da anelli boroxol e non da unità BO3. Tuttavia, il G-B2O3 può cristallizzare in α-b2O3, che implicherebbe un'interconversione di anelli ai triangoli e definirebbe anche il grado di cristallizzazione raggiunto.
Proprietà
Aspetto fisico
È un solido incolore e vetroso. Nella sua forma cristallina è bianco.
Massa molecolare
69.6182 g/mol.
Gusto
Leggermente amaro
Densità
-Cristallino: 2,46 g/ml.
-Vitreous: 1,80 g/ml.
Punto di fusione
Non ha un punto di fusione completamente definito, perché dipende da quanto sia cristallino o vitreo. La forma puramente cristallina si scioglie a 450 ° C; Tuttavia, la forma vitrea si scioglie in un intervallo di temperatura che copre da 300 a 700ºC.
Punto di ebollizione
Ancora una volta, i valori segnalati non corrispondono a questo valore. Apparentemente l'ossido di boro liquido (fuso dai suoi cristalli o il suo vetro) bolle a 1860 ° C.
Stabilità
Deve essere mantenuto asciutto, poiché assorbe l'umidità per trasformarsi in acido borico, B (OH)3.
Nomenclatura
L'ossido di boro può essere nominato in altri modi, come:
-Triossido di DIBORO (nomenclatura sistematica).
-Ossido di boro (III) (nomenclatura delle scorte).
-Ossido borico (nomenclatura tradizionale).
Applicazioni
Alcuni degli usi dell'ossido di boro sono:
Sintesi di Boro Trihalogogenuros
Da b2O3 può essere sintetizzato da Trihalogenuros de Boro, BX3 (X = f, cl y br). Questi composti sono acidi Lewis e con essi è possibile introdurre atomi di boro in alcune molecole per ottenere altri derivati con nuove proprietà.
Può servirti: ioni poliiatomici: elenco ed eserciziInsetticida
Una miscela solida con acido borico, b2O3-B (OH)3, rappresenta una formula che viene utilizzata come insetticida domestica.
Solvente di ossidi metallici: formazione di vetro, ceramiche e leghe di boro
L'ossido di boro liquido è in grado di dissolvere gli ossidi metallici. Da questa miscela risultante, una volta raffreddata, si ottengono solidi composti da boro e metalli.
A seconda della quantità di b2O3 Utilizzato, nonché la tecnica e il tipo di ossido metallico, una ricca varietà di vetro (borosilicati), ceramica (nitruri e carburi di boro) e possono essere ottenute le leghe (se vengono utilizzati solo metalli).
In generale, il vetro o la ceramica acquisiscono una maggiore resistenza e resistenza e anche una maggiore durata. Nel caso del vetro, finiscono per essere utilizzati per lenti ottiche e telescopi e per dispositivi elettronici.
Raccoglitore
Nella costruzione di forni per fonderia in acciaio, vengono utilizzati mattoni refrattari con magnesio. In essi, l'ossido di boro viene usato come legante, aiutando a mantenerli fortemente uniti.
Riferimenti
- Ossido borico. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov
- Ossido di borix. 20 Mule Team Borax. Recuperato da: borace.com

