Voltamperometria
- 4418
- 1367
- Rosolino Santoro
 La voltamperometria è un metodo elettrochimico che misura la corrente di un elettrodo
La voltamperometria è un metodo elettrochimico che misura la corrente di un elettrodo Cos'è la voltamperometria?
IL voltamperometria È una tecnica elettroanalitica che determina le informazioni da una specie chimica o analita dalle correnti elettriche generate dalla variazione di un potenziale applicato. Cioè, il potenziale E (v) applicato e il tempo (t), sono le variabili indipendenti; Mentre la corrente (a), la variabile dipendente.
Le specie chimiche dovrebbero normalmente essere elettroattive. Ciò significa che deve perdere (ossidare) o vincere (ridurre) elettroni. Affinché la reazione inizi, l'elettrodo di lavoro deve fornire teoricamente il potenziale necessario dall'equazione di Nernst.
Questo metodo è ampiamente utilizzato in inorganici, biochimici e chimica fisica, in particolare per analizzare i processi di ossidazione, riduzione o adsorbimento, tra gli altri.
Come funziona la voltamperometria?
Voltamperometry è stata sviluppata grazie all'invenzione del premio Nobel per chimica Nobel del 1922, Jaroslav Heyrovsky (1890-1967). In esso, l'elettrodo a goccia di mercurio (EGM) è costantemente rinnovato e polarizzato.
Le carenze analitiche di questo metodo in quel momento sono state risolte con l'uso e la progettazione di altri microelettrodi. Questi variano notevolmente dal materiale, da carbone, metalli nobili, diamanti e polimeri, anche nel suo design, dischi, cilindri, fogli; E inoltre, nel modo in cui interagiscono con la soluzione: stazionario o rotante.
Tutti questi dettagli sono previsti1). Ciò è proporzionale alla concentrazione dell'analita e metà del potere E (E (E1/2) per raggiungere la metà di questa corrente (i1/2) è caratteristico della specie.
Quindi, determinare i valori di E1/2 Nella curva in cui la corrente ottenuta con la variazione di E è grafica, chiamata Voltamperaogram, La presenza di un analita può essere identificata. Cioè, ogni analita, date le condizioni dell'esperimento, avrà il proprio valore di E1/2.
Può servirti: punto di equivalenzaOnda voltamperometrica
In voltamperometria lavoriamo con molti grafici. Il primo è la curva e vs. t, che consente di monitorare le potenziali differenze applicate in funzione del tempo.
Ma allo stesso tempo, il circuito elettrico registra i valori C prodotti dall'analita quando si perdono o guadagnano elettroni in prossimità dell'elettrodo.
Poiché l'elettrodo è polarizzato, meno analita può essere diffuso dal seno della soluzione ad esso. Ad esempio, se l'elettrodo ha una carica positiva, specie x- Sarà attratto da questo e lo condurrà per la semplice attrazione elettrostatica.
Ma x- non è solo: ci sono altri ioni presenti nel tuo ambiente. Alcuni cationi m+ Possono ostacolare l'elettrodo individuandolo in "cluster" di cariche positive; E anche, anioni n- Possono essere rubati attorno all'elettrodo e prevenire x- Arrivo da lui.
La somma di questi fenomeni fisici provoca la perdita di corrente, e questo è osservato nella C vs. E e la sua forma simile a quella di una s, chiamata forma sigmoideo. Questa curva è nota come onda voltamperometrica.
Strumentazione
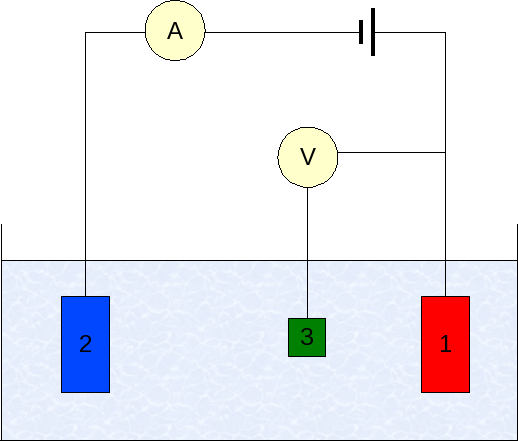 Elettrodi in voltamperometria. Fonte: Wikimedia Commons
Elettrodi in voltamperometria. Fonte: Wikimedia Commons La strumentazione della voltamperometria varia in base all'analita, al solvente, al tipo di elettrodo e all'applicazione. Ma la stragrande maggioranza di essi si basa su un sistema composto da tre elettrodi: uno di lavoro (1), ausiliario (2) e il riferimento (3).
L'elettrodo di riferimento principale utilizzato è l'elettrodo Calomenanos (ECS). Questo, insieme all'elettrodo di lavoro, consente di stabilire una differenza potenziale ΔE, poiché il potenziale dell'elettrodo di riferimento rimane costante durante le misurazioni.
Può servirti: selenio: storia, proprietà, struttura, ottenimento, usiD'altra parte, l'elettrodo ausiliario è responsabile del controllo del carico che passa all'elettrodo di lavoro, al fine di mantenerlo all'interno dei valori accettabili. La variabile indipendente, la differenza potenziale applicata, è quella ottenuta dalla somma dei potenziali degli elettrodi di lavoro e del riferimento.
Tipi di voltamperometria
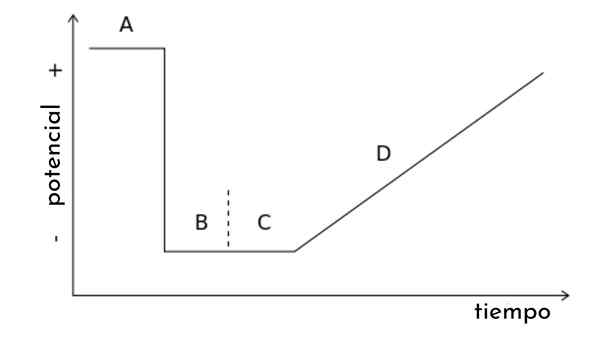
Nell'immagine dell'articolo viene mostrato un grafico. T, chiamato anche onda potenziale per la voltamperometria di scansione lineare.
Si può vedere che col passare del tempo, il potenziale aumenta. A sua volta, questa spazzata genera una curva di risposta o Voltamperaogram C vs. E, la cui forma sarà sigmoide. Verrà un punto in cui, indipendentemente da come aumenta, non ci sarà un aumento della corrente.
Altri tipi di voltamperometria possono essere dedotti da questo grafico, modificando l'onda potenziale. t da improvvisi potenziali impulsi che seguono alcuni schemi. Ogni modello è associato a un tipo di voltamperometria e comprende la propria teoria e condizioni sperimentali.
Voltamperometria a impulsi
In questo tipo di voltamperometria è possibile analizzare le miscele di due o più analiti i cui e e1/2 sono molto vicini l'uno all'altro.
Pertanto, un analita con E1/2 di 0.04v può essere identificato in compagnia di un altro con un E1/2 di 0.05v. Mentre nella voltamperometria di scansione lineare, la differenza deve essere maggiore di 0.2v.
Pertanto, vi è maggiore sensibilità e limiti di rilevamento più bassi; cioè, gli analiti possono essere determinati a concentrazioni molto basse.
Le onde potenziali possono avere schemi simili alle scale, alle scale inclinate e ai triangoli. Quest'ultimo corrisponde alla voltamperometria ciclica (CV).
Può servirti: reagente limitante ed eccessivoNel CV un potenziale e si applica in un certo senso, positivo o negativo, e poi, con un certo valore di E in un momento, lo stesso potenziale ma nel senso opposto è ri -applicato. Quando si studiano i voltapeogrammi generati, i massimi rivelano la presenza di intermediari in una reazione chimica.
Voltamperometria di ridisoluzione
Questo può essere di tipo anodico o catodico. È costituito dall'elettrodeposizione dell'analita su un elettrodo di mercurio. Se l'analita è uno ione metallico (come il CD2+), si formerà un amalgama; E se è un anione (come Moo42-), un sale di mercurio insolubile.
Quindi, vengono applicati potenziali impulsi per determinare la concentrazione e l'identità delle specie Electrodepos. Pertanto, l'amalgama è redisuelve, proprio come i sali di mercurio.
Applicazioni di voltamperometria
- La voltamperometria di ridisoluzione anodica viene utilizzata per determinare la concentrazione di metalli dissolti dal fluido.
- Permette di studiare la cinetica dei processi redox o di adsorbimento, specialmente quando gli elettrodi vengono modificati per rilevare un analita specifico.
- La sua base teorica è servita per la produzione di biosensori. Con questi, la presenza e la concentrazione di molecole biologiche, proteine, grassi, zuccheri, ecc.
- Infine, rileva la partecipazione di intermediari nei meccanismi di reazione.
Riferimenti
- González m. (2010). Voltamperometria. Recuperato da: chimica.Laguia2000.com
- Chemistry and Science (2011). Voltamperometria. Estratto da: Thequimica andlaciencia.Blogspot.com
- Quiroga a. (2017). Voltammetria ciclica. Recuperato da: Chem.Librettexts.org
- Samuel p. Kouves (s.F.). Tecniche voltammetriche. [PDF]. Tufts University. Recuperato da: marrone.Edu
- Giorno r. & Underwood a. Chimica analitica quantitativa (Quinto ed.). Pearson Prentice Hall.

