Struttura di Torio, proprietà, ottenimento, usi

- 4311
- 759
- Dante Morelli
Lui Torio È un elemento metallico che appartiene alla serie di actinidi, delle così terre rare chiamate e il cui simbolo chimico è Th. Ha un numero atomico di 90 e un peso atomico di 232 g/mol. I composti di Torio di solito lo contengono con numero di ossidazione +4 (th4+).
Il composto di biossido di Torio, tho2, È noto industrialmente come Toria ed è utilizzato nella maggior parte delle applicazioni di Toroum, caratterizzato dall'essere il composto chimico con il più grande punto di fusione (3.300 ºC).
 Campione di torio metallico immagazzinato in una vessia di vetro sotto l'argon. Il suo rivestimento nerastro è dovuto al suo ossido. Fonte: Alchemist-HP (talk) (www.PSE-Mendelejew.de) / fal
Campione di torio metallico immagazzinato in una vessia di vetro sotto l'argon. Il suo rivestimento nerastro è dovuto al suo ossido. Fonte: Alchemist-HP (talk) (www.PSE-Mendelejew.de) / fal Il Torio fu scoperto nel 1828 da Mortar Thrane Esmark, che trovò sull'isola norvegese di Løvøya un minerale nero. Esmark ha consegnato il minerale a Jöns Jacob Berzelius, che lo ha analizzato trovando un metallo sconosciuto in lui.
Chiamò il minerale nero come Torita (Thorita) in onore del dio scandinavo Thor. Nel frattempo, il metallo sconosciuto si chiamava Torio (Thorium). Il carattere radioattivo del Thorium è stato istituito da Anton Edward Van Arkel e Jan Hendrik de Boer, e indipendentemente da Pierre Curie e Marie Curie.
[TOC]
Proprietà torium
Fisico
Il Thorium è un metallo bianco radioattivo, luminoso, moderatamente duro, argento, duttile e malleabile, che si accumula molto lentamente in aria, diventando grigio e successivamente nero. Appartiene al gruppo di actinidi, identificandosi con il numero atomico 90 e un peso atomico di 232 g/mol.
Radioattività
Il Torio-232 (232Th90) costituisce oltre il 99% dell'elemento torium totale presente nella corteccia terrestre. Si può prendere in considerazione che si tratti di un isotopo stabile, nonostante sia radioattivo, poiché la sua mezza vita è 1.405 x 1010 anni. Diminuisce radioattivamente per emissione di particelle α e β e radiazione γ.
Il Torio-232 si trasforma in Radio-268 (268RA88) emettendo una particella alfa, costituita da due protoni e due neutroni. Il torio può subire una serie di disintegrazioni radioattive fino a quando non diventa un elemento stabile: Lead-208.
Può servirti: cloruro di piombo: proprietà, struttura, usiIl Torio-232 è in grado di catturare i neutroni per trasformarsi nell'elemento radioattivo uranio-233, emettendo radiazione di tipo β. L'uranio, d'altra parte, viene utilizzato nei reattori nucleari per la produzione di energia.
Reattività
Il torio è un metallo elettropositivo e altamente reattivo. Si ossida molto lentamente nell'aria, sebbene la corrosione possa verificarsi dopo diversi mesi. Se riscaldato in aria, viene acceso, emettendo una luce bianca brillante mentre la produzione di biossido di Torio, tho2.
In condizioni di temperatura e pressione standard il torio viene lentamente attaccato dall'acqua. Allo stesso modo, il torio non viene sciolto nei più comuni acidi, ad eccezione dell'acido cloridrico, dove si dissolve lasciando un residuo nero e insolubile.
Viene anche sciolto in acido nitrico concentrato con una piccola quantità di fluoruro catalitico o fluorosilicato. Il torio è un metallo piroforo: quando diventa polvere è in grado di accendere spontaneamente.
Struttura
Gli atomi di Torio formano un cristallo a struttura cubica centrata su facce (FCC) a temperatura ambiente. Quando viene riscaldato sopra 1360 ºC, il vetro subisce una transizione alla fase cubica centrata sul corpo (BCC), a bassa densità. Nel frattempo, il Thorium sotto alte pressioni (100 GPA o più), acquisisce una densa struttura tetragonale centrata sul corpo (BCT).
Configurazione elettronica
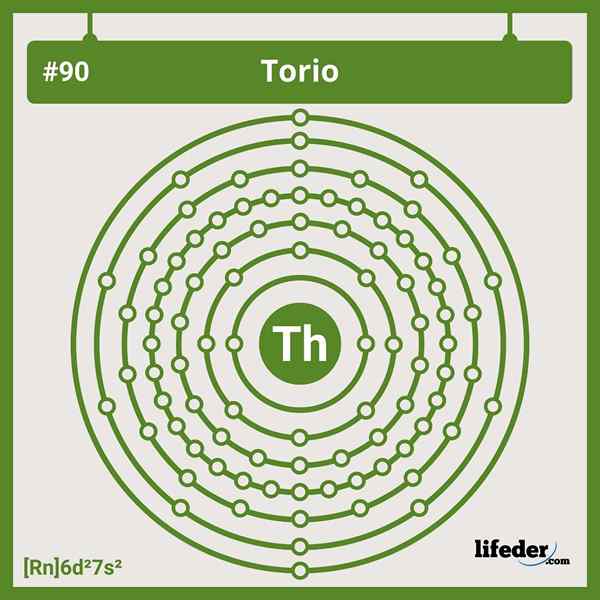 Impostazioni elettroniche del torium
Impostazioni elettroniche del torium La configurazione elettronica abbreviata per il torio è la seguente:
[RN] 6D2 7s2
Perdere i suoi quattro elettroni di Valencia si trasforma nel thr cation4+. Si noti che nonostante sia una recitazione, manca di elettroni nei suoi orbitali 5F, in contrasto con gli altri Actinidi.
Può servirti: fase di dispersioneOttenimento
Il minerale principale usato per ottenere il torio è il monacite. Il passo iniziale è la sua separazione dal suo deposito primario: la pegmatata. I carbonati di metalli alcalinotherro vengono eliminati dalla pegmatite mediante reazione dei loro frammenti con cloruro di idrogeno.
I frammenti risultanti sono calcolati e filtrati, quindi sottoposti a una separazione magnetica. Quindi si ottiene un materiale sabbioso di monacita. Questa sabbia è soggetta a una digestione dell'acido solforico al 93%, a una temperatura da 210 a 230 ° C e per diverse ore. La soluzione acida formata viene successivamente diluita con acqua dieci volte il suo volume.
I resti di Monacita affondano sul fondo, mentre il torio e gli altri elementi della terra rara galleggiano nella preparazione dell'acido. PH a 1 è regolato.3, che produce le precipitazioni del torio come fosfato, mentre il resto della terra rara in sospensione rimane in soluzione.
Attualmente la separazione e la purificazione vengono eseguite utilizzando solventi liquidi, ad esempio fosfato tributo a Querosenosk.
Il metallo di Torio può verificarsi in quantità commerciali mediante riduzione metallotermale in Totrafluoror de Torio (THF4) e biossido di Torio (tho2) o mediante elettrolisi del tetracloruro di torio (THCL4).
Applicazioni
Il torio ha avuto molte applicazioni, molte delle quali sono state scartate dagli anni '50, perché il suo carattere radioattivo costituiva un rischio per la salute.
Industriali
Leghe
Il torio è stato assegnato con il tungsteno come elettrodo nella saldatura TIG (gas inerte di tungsteno), che costituisce il 2% della lega.
In piccole quantità è stato aggiunto Torio ai filamenti di tungsteno per ridurne la cristallizzazione, consentendo così l'emissione di elettroni a temperature più basse. I fili di tungsteno-torio sono stati utilizzati nei tubi elettronici e negli elettrodi dei raggi X e nei tubi.
Il biossido di Torio è stato utilizzato nella saldatura ad arco di tungsteno, poiché aumenta la resistenza al tungsteno alle alte temperature degli elettrodi metallici. Tuttavia, è stato sostituito in questa applicazione da ossidi di circostatore, Cerio o Lantano.
Può servirti: da dove viene la plastica? Storia e tipiFulmine
Totrafluoror de Torio, d'altra parte, è stato usato come materiale per ridurre i riflessi nei rivestimenti ottici multicapa, che sono trasparenti alla luce con una lunghezza d'onda tra 0.350 a 1.2 µm. Tuttavia, il sale di Torio è stato sostituito in questo uso dal tetrafluoro de Lantano.
Il biossido di Torio è stato usato nell'illuminazione della luce, per emettere una luce brillante corrispondente alla luce visibile. Sebbene il torio sia ancora utilizzato in questa applicazione, è stato parzialmente sostituito da Ite.
Materiali refrattari
Il Thorium è stato anche utilizzato nell'elaborazione di materiali refrattari per l'industria metallurgica e in crisi ceramiche per i laboratori di insegnamento e ricerca.
Reattori nucleari
Il Torio-232 viene utilizzato nei reattori nucleari per catturare i neutroni a moto lento, poiché farlo si trasforma in uranio-233. Questo elemento radioattivo è fisicamente e viene utilizzato per la produzione di energia.
Lo sviluppo di reattori nucleari basati sul Torio-32 è stato lento, creando il primo reattore con questa caratteristica nel centro energetico di Point Indian, situato a Buchanan USA, nell'anno del 1962. I reattori nucleari di Torio-232 non emettono plutonio, il che li rende meno inquinanti.
Riferimenti
- SHIVER & ATKINS. (2008). Chimica inorganica. (quarta edizione). Mc Graw Hill.
- Wikipedia. (2020). Torio. Recuperato da: in.Wikipedia.org
- National Center for Biotechnology Information (2020). Torio. Pubchem Comunund Sommario per CID 23974. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov
- Dottore. Doug Stewart. (2020). Fatti per elementi di Thorium. Recuperato da: Chemicool.com
- I redattori di Enyclopedia Britannica. (2020). Torio. Recuperato da: Britannica.com
- Lentech b.V. (2020). Torio. Recuperato da: lentech.com
- Rachel Ross. (1 marzo 2017). Fatti sul torio. Recuperato da: LiveScience.com
- Adomeg. (2020). Torio. Recuperato da: chimica esplicata.com

